
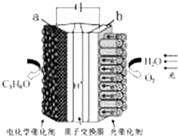
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化 为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化 为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从b极区向a极区迁移 | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | a 电极的反应为:3CO2+18H+-18e-═C3 H8O+5 H2 O |
分析 A、该装置是电解池装置,是将电能转化为化学能;
B、与电源正极相连的是电解池的阳极,负极相连的是电解池的阴极,a与电源负极相连,所以a是负极阴极,而电解池中氢离子向阴极移动;
C、电池总的方程式为:6CO2+8H2O$\frac{\underline{\;通电\;}}{\;}$2C3H8O+9O2,即生成9mol的氧气,阴极有6mol的二氧化碳被还原,由此分析解答;
D、a与电源负极相连,所以a是负极阴极,电极反应式为:3CO2+18H++18e-=C3H8O+5H2O.
解答 解:A、该装置是电解池装置,是将电能转化为化学能,所以该装置将光能和电能转化为化学能,故A错误;
B、a与电源负极相连,所以a是负极阴极,而电解池中氢离子向阴极移动,所以H+从阳极b极区向阴极a极区迁移,故B正确;
C、电池总的方程式为:6CO2+8H2O$\frac{\underline{\;通电\;}}{\;}$2C3H8O+9O2,即生成9mol的氧气,阴极有6mol的二氧化碳被还原,也就是1mol的氧气,阴极有$\frac{2}{3}$mol的二氧化碳被还原,所以被还原的二氧化碳为29.3g,故C错误;
D、a与电源负极相连,所以a是阴极,发生还原反应,电极反应式为:3CO2+18H++18e-=C3H8O+5H2O,故D错误;
故选B.
点评 本题考查电化学的相关知识,学生要清楚电解池的反应原理,阴极发生还原反应,阳极发生氧化反应,以及离子的移动方向就可以迅速解题了,比较容易.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
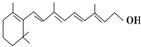 ,关于它的正确说法是( )
,关于它的正确说法是( )| A. | 维生素A分子式为C20H30O | |
| B. | 维生素A是一种易溶于水的醇 | |
| C. | 维生素A不易被氧化 | |
| D. | 1 mol维生素A最多可以和6 mol氢气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
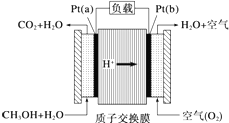 科学家预言,燃料电池将是 21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极,电池中的质子交换膜只允许 H+ 和水分子通过.其工作原理的示意图如下.下列说法错误的是( )
科学家预言,燃料电池将是 21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极,电池中的质子交换膜只允许 H+ 和水分子通过.其工作原理的示意图如下.下列说法错误的是( )| A. | a 是负极,b 是正极 | |
| B. | b 极的电极反应是 O2+4H++4e-═2H2O | |
| C. | 放电过程中,电子流动方向为:a→b→质子交换膜→a | |
| D. | 当电路上通过 2 mol 电子消耗的 CH3OH 为 $\frac{1}{3}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用如图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
用如图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com