
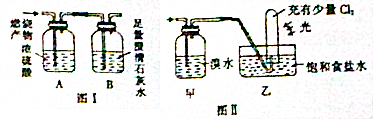
分析 (1)气体总物质的量为0.1mol,由于CO和X物质的量相等,因此X为0.05mol,CO燃烧产生CO2,X燃烧产生CO2和H2O,浓硫酸只吸收H2O,又由于甲烷和乙烯分子中均有4个氢,因此0.05mol甲烷或乙烯燃烧均产生0.1molH2O,所以浓硫酸增重1.8g;
(2)澄清石灰水吸收二氧化碳;经测定,实验前后装置B增重4.4g,n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,则0.05molX含有0.05molCO2,X含有一个碳原子,X为甲烷;
(3)甲烷与溴水不反应;光照条件下,甲烷与氯气发生取代反应.
解答 解:(1)气体总物质的量为0.1mol,由于CO和X物质的量相等,因此X为0.05mol,CO燃烧产生CO2,X燃烧产生CO2和H2O,浓硫酸只吸收H2O,又由于甲烷和乙烯分子中均有4个氢,因此0.05mol甲烷或乙烯燃烧均产生0.1molH2O,所以浓硫酸增重1.8g;
故答案为:1.8;
(2)澄清石灰水吸收二氧化碳,离子方程式为CO2+Ca2++2OH-=CaCO3↓+H2O;经测定,实验前后装置B增重4.4g,n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,则0.05molX含有0.05molCO2,X含有一个碳原子,X为甲烷;
故答案为:CO2+Ca2++2OH-=CaCO3↓+H2O;CH4;
(3)甲烷与溴水不反应;光照条件下,甲烷与氯气发生取代反应,试管内气体颜色变浅,试管内壁有油状液滴出现;
故答案为:溴水不褪色;试管内气体颜色变浅,试管内壁有油状液滴出现.
点评 本题考查有机物分子式的确定及其性质,难度不大,根据浓硫酸增重、澄清石灰增重求出H2O、CO2是解题的关键.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素种类 | B. | 核电荷数 | C. | 电子层数 | D. | 中子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表为元素周期表短周期的一部分.回答下列问题:
如表为元素周期表短周期的一部分.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 | |
| B. | 500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中充分反应生成NH3(g),放热7.72kJ,其热化学方程式为: N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 对于可逆反应N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g),△H<O;升高温度,可使反应速率增大,反应逆向移动 | |
| D. | 元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,该反应属于取代反应,有机物的名称是硝基苯.
,该反应属于取代反应,有机物的名称是硝基苯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解 滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡 | 有白色沉淀生成 | 样品含NaCl |
| ② | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解 加入过量BaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于9.6 | 样品含NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5730×3年 | B. | 5730×4年 | C. | 5730×6年 | D. | 5730×8年 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机化合物都是从有机体中提炼出来的 | |
| B. | 有机物和无机物的性质完全不同 | |
| C. | 所有有机物均含有碳元素 | |
| D. | 所有有机物均含有氢元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com