
分析 分别根据c=$\frac{n}{V}$计算出混合液中HAc、HCN的浓度;由于Ka(HAC)=1.75×10-5>Ka(HCN)=6.2×10-10,则溶液中c(H+)≈c(Ac-),分别根据各自的电离平衡常数列式计算即可.
解答 解:混合液中HAc的浓度为:$\frac{0.200mol/L×0.1L}{0.1L+0.3L}$=0.05mol/L,HCN的浓度为:$\frac{0.400mol/L×0.3L}{0.1L+0.3L}$=0.3mol/L,
由于Ka(HAC)=1.75×10-5>Ka(HCN)=6.2×10-10,则溶液中c(H+)≈c(Ac-),
设混合液中c(H+)=c(Ac-)=x,则Ka(HAC)=$\frac{c({H}^{+})×(A{c}^{-})}{c(HAc)}$=$\frac{{x}^{2}}{0.05-x}$=1.75×10-5,由于x较小,则0.05-x≈0.05,则x2=8.75×10-7,解得:x≈9.35×10-4mol/L,则溶液中c(H+)≈c(Ac-)=9.35×10-4mol/L;
Ka(HCN)=6.2×10-10mol/L,c(HCN)≈0.3mol/L,则c(CN-)=$\frac{6.2×1{0}^{-10}×c(HCN)}{c({H}^{+})}$=$\frac{6.02×1{0}^{-10}×0.3}{9.35×1{0}^{-4}}$≈1.93×10-10mol/L,
答:该混合液中各离子浓度为:c(H+)≈c(Ac-)=9.35×10-4mol/L、c(CN-)=1.93×10-10mol/L.
点评 本题考查了电离平衡常数的计算,题目难度中等,明确电离平衡常数的概念及表达式为解答关键,试题有利于培养学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:多选题
| A. | 有机物 属于芳香烃,含有两种官能团 属于芳香烃,含有两种官能团 | |
| B. | 按系统命名法,化合物 的名称为2,3,6三甲基5乙基庚烷 的名称为2,3,6三甲基5乙基庚烷 | |
| C. |  既属于醇类又属于羧酸 既属于醇类又属于羧酸 | |
| D. | 2甲基3丁烯的命名错误原因是选错了主链 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
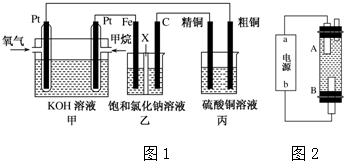
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )
如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )| A. | 钠悬浮在煤油层中 | |
| B. | 钠静止在两液面之间 | |
| C. | 钠沉入水底下 | |
| D. | 钠熔化成闪亮的小球,在两液体界面附近上下跳动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验 操 作 | 现 象 | 实 验 结 论 | |
| A | 向某溶液中加入硝酸酸化的氯化钡溶液 | 生成白色沉淀 | 溶液中一定含有SO42- |
| B | 将某溶液蘸取少量放置于火焰上灼烧 | 火焰呈黄色 | 该溶液中一定含K+ |
| C | 往某溶液中加入KSCN溶液 | 显血红色 | 溶液中一定含有Fe3+ |
| D | 往某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2CO3和NaHCO3形成的混合溶液中:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| B. | 0.1mol•L-1NaHSO3溶液中通入NH3至溶液pH=7:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 物质的量浓度相等的:①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液、④(NH4)2Fe(SO4)2溶液中c(NH4+)的大小关系:④>①>②>③ | |
| D. | 0.1mol•L-1CH3COONa溶液中通入HCl至溶液pH=7:c(Na+)>c(CH3COOH)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 高锰酸钾溶液体积(ml) | 废水样品的体积(ml) |
| 1 | 10.02 | 25.00 |
| 2 | 10.62 | 25.00 |
| 3 | 9.98 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
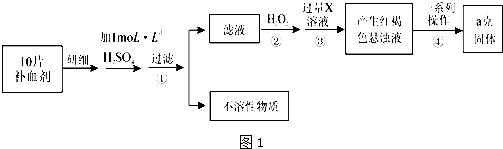
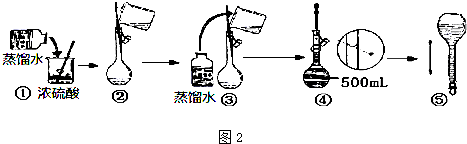
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com