
| n |
| V |


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
| A、铝是较活泼的金属,能跟盐酸、稀硫酸、氢氧化钠溶液反应放出氢气 |
| B、镁铝合金的强度和硬度都比纯铝和纯镁大 |
| C、常温下,铝能和空气里的氧气反应生成一层致密的氧化膜,从而失去光泽 |
| D、镁着火可以用CO2来灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是铊化钠的晶胞结构:
如图是铊化钠的晶胞结构:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
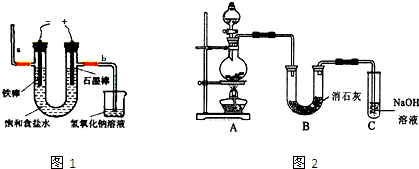
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是用于简单有机化合物的制备、分离、提纯常见的简易装置.请根据该装置回答下列问题:
如图是用于简单有机化合物的制备、分离、提纯常见的简易装置.请根据该装置回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com