
| A. | ①②③④⑤⑦⑧ | B. | ①④⑦⑧ | C. | ①⑥ | D. | ①④⑤⑦⑧ |
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{44}$ mol-1 | B. | $\frac{x}{22}$ mol-1 | C. | $\frac{3x}{44}$ mol-1 | D. | $\frac{44x}{3}$ mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质不一定能导电 | |
| B. | 氨溶于水得到的氨水能导电,所以氨水是电解质 | |
| C. | 将硫酸钡放入水中不能导电,所以硫酸钡是非电解质 | |
| D. | 在水溶液或熔融状态下能导电的物质叫做电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
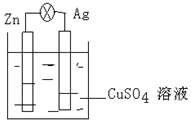 (1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,该电极上发生的电极反应式为Zn-2e-=Zn2+,银电极上发生的是还原反应(“氧化”或“还原”).
(1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,该电极上发生的电极反应式为Zn-2e-=Zn2+,银电极上发生的是还原反应(“氧化”或“还原”). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com