
| 2min | 4min | 6nin | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.20 | … |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | … |

分析 (1)①根据表中2min和4min时各种物质的浓度的变化量,结合转化量之比等于方程式计量系数之比可计算出x;
②该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$,将在250℃下,将4min时各物质平衡浓度带入计算;
③根据6min到8min时各物质浓度的变化来确定改变条件;
④求出第8min时反应的浓度商Qc,与250℃时K做比较,若Qc=K反应达到平衡状态;
(2)根据能量变化图,则反应断键共吸收2×630+2×436=2132kJ,形成共放出945+4×463=2797kJ,所以该反应共放出2797-2132=665kJ的热量,据此写出H2还原NO生成氮气和水蒸气的热化学方程式.
解答 解:(1)①从图中可知,从2min到4min时各物质的浓度变化之比=△c(CO):△c(H2):△c(CH3OH)=(0.07-0.06):(x-0.12):(0.04-0.03),
化学反应中各物质的转化量之比等于方程式的计量系数得:(0.07-0.06):(x-0.12):(0.04-0.03)=1:2:1,解得:x=0.14,
故答案为:0.14;
②250℃下,甲醇的平衡浓度是0.06mol/L,氢气的平衡浓度是0.12mol/L,一氧化碳的平衡浓度是0.04mol/L,所以平衡常数为:K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$=$\frac{0.04}{0.06×0.1{2}^{2}}$,
故答案为:$\frac{0.04}{0.06×0.1{2}^{2}}$;
③对比6min和8min时各物质的浓度可知改变条件后反应反应向正方向进行,按照转化量之比等于计量系数之比△C(CO):△C(H2):△C(CH3OH)=0.01mol/L:0.02mol/L:0.01mol/L,所以8min后三种物质的浓度应为:(0.06-0.01)mol/L、(0.12-0.02)mol/L、(0.04+0.01)mol/L,而8min后氢气的浓度为0.2mol/L,所以多加了0.1mol/L×10=1mol的氢气;
故答案为:加1 mol氢气;
④第8min时反应的浓度商为:Qc=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$=$\frac{0.05}{0.05×0.22}$=$\frac{1}{0.04}$≠K,所以此时没有达到平衡状态,
故答案为:不是;
(2)根据能量变化图可知,则反应断键共吸收2×630+2×436=2132kJ,形成共放出945+4×463=2797kJ,所以该反应共放出2797-2132=665kJ的热量,则H2还原NO生成氮气和水蒸气的热化学方程式是:2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-665 kJ•mol-1,
故答案为:2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-665 kJ•mol-1.
点评 本题考查较为综合,题目难度中等,涉及化学平衡移动的影响因素、化学平衡常数的计算和应用和盖斯定律求反应热,题目综合性强,充分考查了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
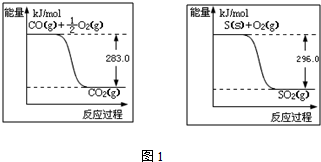
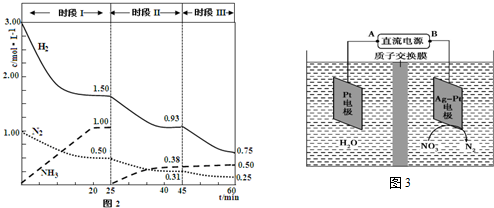
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图4表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图4表示:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有广泛的开发和应用前景.
甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
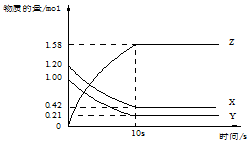 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应的化学方程式为:X(g)+Y(g)?Z(g) | |
| D. | 反应开始到10s时,Y的转化率为79.0% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com