
��ů�����Ǻ�������ѧ��ѧ�ҽ�ˮ����һ���㹻ǿ�ĵ糡�У���20��ʱ��ˮ����˲�������γɵġ�ij��ʦ�ڿ���������һ����ͼ��ʾ��ʵ�飬�����ձ�������KMnO4��Һ��ɫ�������ձ��е���Һ���ɺ�������KSCN ��FeCl2��Һ������Һ��Ѫ��ɫ��������˵���в���ȷ����( )
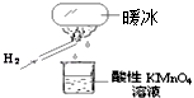
A���ڵ糡�����£�ˮ���Ӽ�����γ��������������Ƶá�ů����
B��ˮ�����γ�20��ʱ�ġ�ů�����������ı仯�ǻ�ѧ�仯
C����������H2ȼ�������˼Ⱦ����������־��л�ԭ�Ե�����
D����������H2ȼ�յIJ����п��ܺ���һ������H2O2

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�캣��ʡ������ǰģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������������0���̶�λ����ȷ���ǣ� ��
A������Ͳ���϶�
B���ڵζ����϶�
C����������ƽ�̶ȳߵ�����
D����������ƽ�̶ȳߵ��ұ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��ʡ�߶�6���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���и���������ָ������Һ���ܴ����������( )
����ɫ��Һ�У�K+��Cu2+��Na+��SO42-
��pH=11����Һ�У�CO32-��Na+��AlO2-��NO3-
�ۼ���Al�ܷų�H2����Һ�У�Cl-��HCO3-��NO3-��NH4+
������ˮ�������c(OH-)=10-13mol•L-1����Һ�У�Na+��Ba2+��Cl-��I-
����ʹ��ɫʯ����ֽ��Ϊ��ɫ����Һ��Na+��Cl-��S2-��ClO-
��������Һ�У�Fe2+��Al3+��NO3-��Cl-
A���٢ڢ� B���ڢܢ� C���ڢ� D���ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ɹų����и߶�6���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪����K2Cr2O7��Һ����FeSO4��Ӧ����Fe3+��Cr3+���ֽ������ữ��K2Cr2O7��Һ��FeSO4��Һ��ϣ���ַ�Ӧ������������Һ�м���KI��Һ�������Һ��Fe3+�����ʵ���������KI�����ʵ����ı仯��ϵ��ͼ��ʾ������˵���в���ȷ���ǣ� ��
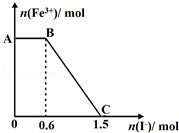
A��ͼ��AB�ε�������ΪK2Cr2O7
B��ͼ��BC�η����ķ�ӦΪ2Fe3++2I��=2Fe2++I2
C����ʼ�����K2Cr2O7Ϊ0.25 mol
D��K2Cr2O7��FeSO4��Ӧ�����ʵ���֮��Ϊ1:3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ɹų����и߶�6���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й����ӷ���ʽ��д�����ӹ���˵����ȷ����
A����0.1 mol/L Na2CO3��Һ�У�Al3+��NH4+��SO42-��NO3-һ���ܴ�������
B�������£�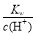 =0.1mol/L����Һ�У���������һ���ܴ������棺K+��Cl-��Fe2+��NO3-
=0.1mol/L����Һ�У���������һ���ܴ������棺K+��Cl-��Fe2+��NO3-
C����ϴ��¯ʱ���ô�����Һ���ݵ���Ҫԭ��CaSO4(s)��CO32-(aq) SO42-(aq)��CaCO3(s)
SO42-(aq)��CaCO3(s)
D����Al2(SO4)3��Һ�м�������Ba(OH)2��Һ��Ba2+��SO42-��Al3+��3OH-��BaSO4����Al(OH)3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��������«��һ�е���У�߶�6��������ѧ���������棩 ���ͣ������
����ѧ����ѡ��3�����ʽṹ�����ʡ�Ŀǰ�뵼������չ����һ����ͭоƬ�����������ڹ�оƬ����ͭ���������ߣ����ϵĽ���ͭ���ִ��Ƽ�Ӧ����ȡ����ͻ�ƣ��û�ͭ��(��Ҫ�ɷ�ΪCuFeS2��������ͭ���䷴Ӧԭ�����£�
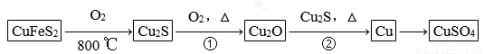
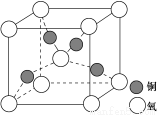
��1����̬ͭԭ�ӵ���Χ�����Ų�ʽΪ__________________������Ԫ����ȣ���һ�����ܽϴ��Ԫ����________(��Ԫ�ط��ţ���
��2����Ӧ�١��� �о���������ͬ��������ӣ��÷��ӵ�����ԭ���ӻ�������____��������ṹ��______��
�о���������ͬ��������ӣ��÷��ӵ�����ԭ���ӻ�������____��������ṹ��______��
��3��ijѧ��������ͭ��Һ�백ˮ����һ��ʵ�飺CuSO4��Һ ��ɫ����
��ɫ���� �����ܽ⣬�õ�����ɫ����Һ��д����ɫ�������ڰ�ˮ�����ӷ���ʽ ___������ɫ����Һ�е�������(������H�����ڴ��ڵ�ȫ����ѧ�������� ��
�����ܽ⣬�õ�����ɫ����Һ��д����ɫ�������ڰ�ˮ�����ӷ���ʽ ___������ɫ����Һ�е�������(������H�����ڴ��ڵ�ȫ����ѧ�������� ��
��4�� ͭ�ǵ�����������Ҫ�Ĺ���Ԫ��֮һ���䵥�ʼ���������й㷺��;��ͭ������ͭԭ�Ӷѻ�ģ��Ϊ_____________��ͭ��ij�������ᄃ���ṹ��ͼ��ʾ�����þ�����ܶ�Ϊd g/cm3�������ӵ�������ֵΪNA����þ�����ͭԭ������ԭ��֮��ľ���Ϊ________pm�� (�ú�d��NA��ʽ�ӱ�ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��������«��һ�е���У�߶�6��������ѧ���������棩 ���ͣ�ѡ����
������Һ�����ʵ���Ũ�ȹ�ϵ��ȷ���ǣ� ��
A��NaHCO3��Һ�У�c��Na+����c��CO32������c��HCO3������c��OH����
B�������£�pH=3��������pH=11�İ�ˮ�������ϣ�������Һ�У�c��Cl������c��NH4+��
C��0.1mol/L CH3COOH��Һ��0.1 mol/L NaOH��Һ�������ϣ�������Һ�У�c��CH3COO����+c��OH����=c��H+��+c��Na+��
D��CH3COONa��Һ��CH3COOH��Һ�����ʵ�����Ϻ���Һ�����ԣ�������Һ�У�c��CH3COOH����c��CH3COO������c��Na+����c��H+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��������«��һ�е���У�߶�6��������ѧ���������棩 ���ͣ�ѡ����
���б������ϻ�ѧ��ʵ����
A��ijƷ�ƻ�ױƷ���ơ����Ǿܾ���ѧ����Ʒ�����κλ�ѧ���ʡ�
B����Ư�۾��ͽ����Ļ��Һ��ϴ��ͰЧ������
C��������ġ�ԭ�Ӿ��á����Ƿ�Ӧ���ԭ��ȫ��ת��Ϊ���������ղ���
D���º��صķ�����ζ����Ԫ�صĺϳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ������ģ���ۻ�ѧ�Ծ��������棩 ���ͣ������
��1������(��Ҫ��Ⱦ��SO2��NOx)��O3Ԥ��������CaSO3ˮ����Һ���գ��ɼ���������SO2��NOx�ĺ�����O3����������SO2��NOx����Ҫ��Ӧ���Ȼ�ѧ����ʽΪ��
NO(g)��O3(g)=NO2(g)��O2(g) ��H=��200��9kJ mol��1
mol��1
NO(g)��1/2O2(g)=NO2(g) ��H=��58��2kJ mol��1
mol��1
SO2(g)��O3(g)=SO3(g)��O2(g) ��H=��241��6kJ mol��1
mol��1
��Ӧ3NO(g)��O3(g)=3NO2(g)�ġ�H=_______KJ/mol��
��2����Cu2O/ZnO�������������£���1molCO��g����2molH2��g�������ݻ�Ϊ2L���ܱ������кϳ�CH3OH��g������Ӧ�����У�CH3OH��g�������ʵ�����n����ʱ�䣨t�����¶ȵĹ�ϵ����ͼ��ʾ��

��������ش��������⣺
����300��ʱ��ƽ�ⳣ��K�� ��
����500�棬�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v��H2�� �� ��
���������������䣬�Դ���Z�����ϵ�������ѹ����ԭ����1/2���ﵽ�µ�ƽ��������йظ���ϵ��˵����ȷ���� ��
a��������Ũ����ԭƽ��ȼ��� b�������淴Ӧ���ʶ��ӿ�
c���״������ʵ������� d������ƽ��ʱn��CO�� /n��CH3OH������
��3������CO��H2�������Ʊ������ѡ����ϳ�����n��H2��/n��CO��=2ͨ��1L�ķ�Ӧ���У�һ�������·�����Ӧ��4H2��g��+2CO��g�� CH3OCH3��g��+H2O��g�� ��H����CO��ƽ��ת�������¶ȡ�ѹǿ�仯��ϵ��ͼ��ʾ������˵������ȷ���� ��
CH3OCH3��g��+H2O��g�� ��H����CO��ƽ��ת�������¶ȡ�ѹǿ�仯��ϵ��ͼ��ʾ������˵������ȷ���� ��
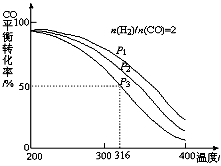
A����H <0
B��P1<P2<P3
C������P3��316��ʱ����ʼʱn��H2��/n��CO��=3����ﵽƽ��ʱ��COת���ʴ���50%
��4�� 25�棬������ĵ���ƽ�ⳣ�����±���

��HSO3-�ĵ���ƽ�ⳣ������ʽK= ��
��0.10 mol L-1NaHSO3��Һ������Ũ���ɴ�С��˳��Ϊ ��
L-1NaHSO3��Һ������Ũ���ɴ�С��˳��Ϊ ��
��H2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com