

分析 (1)由元素在周期表中位置,可知①为H、②为Na、③为Mg、④为Al、⑤为K、⑥为N、⑦为F、⑧为Cl、⑨为Br、⑩为He;
(2)稀有气体化学性质最不活泼;
(3)金属性越强,最高价氧化物对应水化物的碱性越强;
(4)根据同主族自上而下原子半径增大判断;
(5)元素⑥的氢化物为NH3;⑧的氢化物为氯化氢,氯化氢与氨气反应生成氯化铵;
(6)某元素单质的氧化产物既可以和盐酸反应又可以和氢氧化钠溶液反应,应为Al;铝与氢氧化钠溶液反应生成偏铝酸钠和氢气.
解答 解:(1)由元素在周期表中位置,可知①为H、②为Na、③为Mg、④为Al、⑤为K、⑥为N、⑦为F、⑧为Cl、⑨为Br、⑩为He,
故答案为:①H、②Na、③Mg、④Al、⑤K、⑥N、⑦F、⑧Cl、⑨Br、⑩He;H;Mg;Cl;
(2)稀有气体He的化学性质最不活泼,
故答案为:He;
(3)金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:NaOH>Mg(OH)2>Al(OH)3,
故答案为:NaOH;
(4)同主族自上而下原子半径逐渐增大,故三者的原子半径大小为:K>Na>H,
故答案为:K>Na>H;
(5)元素⑥的氢化物为NH3;⑧为Cl元素,其氢化物为HCl,氯化氢与氨气反应生成氯化铵,反应的化学方程式为:NH3+HCl=NH4Cl,
故答案为:NH3;NH3+HCl=NH4Cl;
(6)某元素单质的氧化产物既可以和盐酸反应又可以和氢氧化钠溶液反应,应为Al,其氧化物为氧化铝,氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,熟练掌握原子结构与元素周期表、元素周期律的关系为解答关键,试题充分考查了学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 卤素原子半径越大,氢化物越稳定 | |
| B. | 卤素原子半径越大,氢化物越不稳定 | |
| C. | 卤素氢化物稳定性:HF>HCl>HBr>HI | |
| D. | 卤族单质与氢气越难反应,生成的氢化物越不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
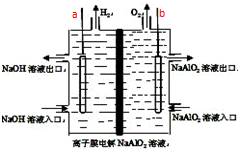 工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )
工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )| A. | 当有0.1mol 电子发生转移时,a极产生气体在标准状况下为112mL | |
| B. | 该电池使用时应选择阴离子交换膜 | |
| C. | 电池工作结束后,左右两侧电解槽均会有Al(OH)3沉淀生成 | |
| D. | 该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2→CO2+2H2O | B. | 2CH3CH2OH+O2→2CH3CHO+2H2O | ||
| C. | CH4+Cl2→CH3Cl+HCl | D. | CH2=CH2+Br2→CH2Br-CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
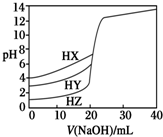 25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A. | 相同浓度时,三种酸的酸性强弱顺序是:HX>HY>HZ | |
| B. | 根据滴定曲线可得,Ka(HX)=10-3 mol•L-1 | |
| C. | 滴定HY,V(NaOH)=20 mL时,c(Na+)=c(Y-)>c(OH-)=c(H+) | |
| D. | 滴定HZ,V(NaOH)=15 mL时,c(Z-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com