
【题目】100mL0.50mol/L盐酸与100mL0.55mol/LNaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
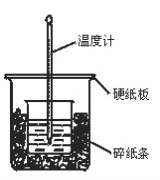
(1)从实验装置图看,尚缺少的一种玻璃仪器是________。
(2)烧杯间填充碎纸条的作用是_________。
(3)按如图装置进行实验,测得中和热的数值_______(填“偏大”“偏小”或“无影响”)其原因是_____。
(4)若实验中改用80 mL0.50mol/L盐酸跟80mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_____(填“相等、“不相等”)。
(5)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.5 |
依据该学生测得的实验数据进行计算,中和热ΔH=______(结果保留一位小数)。
(6)能否用稀Ba(OH)2溶液和稀硫酸代替氢氧化钠溶液和盐酸反应测定中和热_______(填“能”或“否”)。
【答案】环形玻璃搅拌棒 保温隔热,减少实验过程中的热量损失 偏小 大小烧杯杯口不相平,导致热量散失较大 不相等 -51.8kJ/mol 否
【解析】
(1)为加快酸碱中和反应,用环形玻璃搅拌棒搅拌;
(2)填充泡沫或碎纸屑为减少热量损失,以免造成误差;
(3)大小烧杯口未齐平,容易造成气体对流,使热量损失过快;
(4)反应酸、碱的物质的量与原来不同,则释放的热量不同;
(5)根据表中数据,实验3数据明显偏大,舍去不用,利用实验1、2数据进行计算;
(6)Ba(OH)2与硫酸反应生成硫酸钡沉淀和水。
(1)实验中,为加快酸碱中和反应,则用环形玻璃搅拌棒进行搅拌;
(2)为减少热量损失,以免造成误差,在大小烧杯之间填充泡沫或碎纸屑进行绝热处理;
(3)按如图装置进行实验,大小烧杯口未平,容易造成气体对流,使热量损失过快,导致中和热数据偏小;
(4)用80 mL0.50mol/L盐酸跟80mL0.55mol/LNaOH溶液进行反应,酸碱的物质的量与原来不同,则释放的热量不同;
(5)根据表中数据,实验3数据明显偏大,舍去不用,则实验1、2溶液温度的平均变化值=(23.2-![]() +23.4-
+23.4-![]() )℃/2=3.1℃,Q=4.18×200×3.1 J=2591.6J,ΔH=Q/n=2.5916kJ/0.05mol=51.8kJ/mol;
)℃/2=3.1℃,Q=4.18×200×3.1 J=2591.6J,ΔH=Q/n=2.5916kJ/0.05mol=51.8kJ/mol;
(6)Ba(OH)2与硫酸反应生成硫酸钡沉淀和水,硫酸钡存在溶解平衡,使测定的中和热不准确,答案为否。


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,二氧化硫表现氧化性的是( )
A.2SO2+O2![]() 2SO3
2SO3
B. SO2+H2O![]() H2SO3
H2SO3
C.2H2S+SO2=3S↓+2H2O
D.SO2+2H2O+Cl2=H2SO4+2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图在化学实验中有多种用途:

(1)现用此装置收集氨气,气体从_____口通入,若用此装置收集氯气,气体从____口通入。
(2)现有位同学采用排水法收集氨气,其装置如图:

气体从_______口通入,上层液体应选择_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组探究在其他条件不变时,改变某一条件对某类反应aA(g)+bB(g)![]() cC(g)的 化学平衡的影响,得到如图图像(图中p表示压强,T表示温度,n 表示物质的量,α表示转 化率)。下列说法正确的是( )
cC(g)的 化学平衡的影响,得到如图图像(图中p表示压强,T表示温度,n 表示物质的量,α表示转 化率)。下列说法正确的是( )

A.反应Ⅰ的正反应ΔH>0B.若p1>p2,则a+b<c
C.反应Ⅱ的逆反应ΔH>0D.反应Ⅱ中T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在50 mL 4 mol·L-1的氢氧化钠溶液中,通入一定量的硫化氢,反应完毕,在常温减压条件下,用氮气把溶液吹干,得到白色固体7.92 g,通过计算确定白色固体的组成及各组分的质量。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3水溶液呈弱碱性,并可用作农业化肥,现进行下列研究:现将一定量的H2和N2充入10L的密闭容器中,在一定条件下使其发生反应,有关H2、N2、NH3三者的物质的量的变化与时间的关系如图所示:
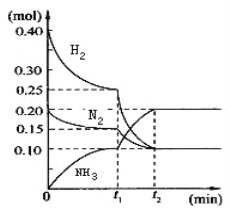
(1)若t1=10min,则0至t1时间内H2的反应速率为_________;
(2)下列几种情形中可以证明合成氨的反应N2(g)+3H2(g)![]() 2NH3(g)已达平衡状态的是_____。
2NH3(g)已达平衡状态的是_____。
①单位时间内生成nmolN2的同时生成2nmolNH3;
②1个N≡N键断裂的同时,有6个N—H键形成;
③1个N≡N键断裂的同时,有3个H—H键形成;
④混合气体的压强不再改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态。
(3)根据图中曲线变化情况判断,t1时刻改变的反应条件可能是_____(填字母)
a.加入了催化剂 b.降低了反应的温度 c.缩小容器体积增大压强
(4)t2时刻后反应达平衡,N2总共的转化率为______。
(5)在t1时刻对应的反应条件下,该反应的平衡常数是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g) + 4H2(g)![]() CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
A. 该反应的ΔH < 0 B. 化学平衡常数K增大
C. CO2的转化率增加 D. 正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g)△H=+57kJmol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是
2NO2(g)△H=+57kJmol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是

A.a、c两点气体的平均相对分子质量:a>c
B.a、c两点气体的颜色:a深,c浅
C.由状态b到状态a,可以用加热的方法
D.a、c两点的反应速率:a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘可利用的资源有限,因此碘的工业回收有重要意义。如图是某研究小组设计的从实验室含碘废液(主要含有![]() 、
、![]() 和淀粉等)中回收获得高纯碘晶体的流程。
和淀粉等)中回收获得高纯碘晶体的流程。
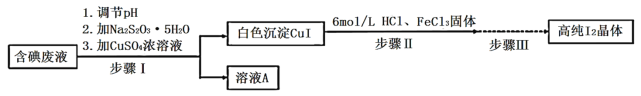
已知:![]() ,
,![]() ,实验条件下
,实验条件下![]() 不与
不与![]() 发生氧化还原反应。回答下列问题:
发生氧化还原反应。回答下列问题:
(1)步骤I中,在装有含碘废液的烧杯中,先加入![]() 固体,在搅拌下溶解后,再慢慢加入硫酸铜溶液,硫酸铜的作用是________。
固体,在搅拌下溶解后,再慢慢加入硫酸铜溶液,硫酸铜的作用是________。
(2)下列有关步骤I的说法正确的是_________________。
A.实验中应调节![]() 为强酸性环境
为强酸性环境
B.![]() 溶液不能先于
溶液不能先于![]() 晶体加入,是为了防止生成的碘挥发而损失
晶体加入,是为了防止生成的碘挥发而损失
C.加入硫代硫酸钠的量应控制至含碘废液的蓝色刚好褪去
D.溶液![]() 中含硫元素的离子可能有
中含硫元素的离子可能有![]() 、
、![]() 、
、![]() 等
等
(3)步骤Ⅱ为反应生成碘并蒸馏出碘的过程,示意图如图所示:
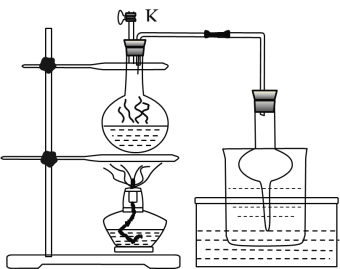
①写出步骤Ⅱ的离子方程式________。
②步骤Ⅱ,检查装置气密性(此时![]() 关闭),在圆底烧瓶中加入
关闭),在圆底烧瓶中加入![]() 和
和![]() 固体及适量
固体及适量![]() ,其后续的操作顺序是________。(选择合理操作,并排序)
,其后续的操作顺序是________。(选择合理操作,并排序)
a.打开![]() b.关闭
b.关闭![]() c. 用酒精灯加热 d. 停止加热 e. 观察到圆底烧瓶中溶液紫色消失
c. 用酒精灯加热 d. 停止加热 e. 观察到圆底烧瓶中溶液紫色消失
③实验后期,发现玻璃管中少量碘晶体凝结,其处理的简易操作方法________;
(4)步骤Ⅲ中,主要涉及的操作依次是抽滤、洗涤、干燥和________。其中,抽滤、洗涤沉淀后的滤纸不能丢弃,应保留到后续操作中,其原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com