
【题目】为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。

实验过程:
I. 打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ. 打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ. 当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ. 打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ. 打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ. 更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是____________________。
(2)棉花中浸润的溶液为__________________。
(3)A中发生反应的化学方程式为_______________。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+ > SO2的是_______(填“甲”“乙”“丙”)。
过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+ SO32-(aq)![]() FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
某同学设计如下实验,证实该假设成立:
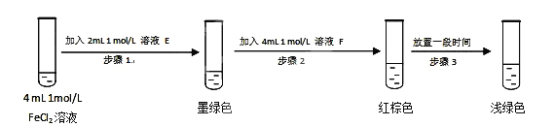
①溶液E和F分别为____________、__________。
②请用化学平衡原理解释步骤3中溶液由红棕色变为浅绿色的原因____________。
【答案】排除装置中的空气,防止干扰 NaOH溶液 MnO2+ 4HCl(浓)![]() MnCl2+ Cl2↑+ 2H2O 70%的硫酸中c(H+)比98%的硫酸大,因此反应速率更快 乙、丙 Na2SO3(或可溶性亚硫酸盐) FeCl3 Fe3+ 消耗 SO32-,c(SO32-)减小,使平衡Fe2+(aq)+ SO32- (aq)
MnCl2+ Cl2↑+ 2H2O 70%的硫酸中c(H+)比98%的硫酸大,因此反应速率更快 乙、丙 Na2SO3(或可溶性亚硫酸盐) FeCl3 Fe3+ 消耗 SO32-,c(SO32-)减小,使平衡Fe2+(aq)+ SO32- (aq)![]() FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色
FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色
【解析】
(1)由于装置中含有空气,空气中的O2会干扰实验,过程Ⅰ中通入一段时间N2,目的是排除装置中的空气,防止干扰。
(2)为了防止多余的Cl2、SO2污染环境,所以棉花中浸润的溶液是NaOH溶液,吸收未反应的Cl2、SO2。
(3)A中二氧化锰与浓盐酸的反应生成MnCl2、氯气、水,该反应的化学方程式为MnO2+ 4HCl(浓)![]() MnCl2+ Cl2↑+ 2H2O。
MnCl2+ Cl2↑+ 2H2O。
(4)因氢离子浓度越大,反应速率越快,98%的硫酸中水太少,70%的硫酸中的氢离子浓度比98%的硫酸中的氢离子浓度大,所以反应速率快。
(5)甲、过程Ⅳ的B溶液中含有的离子有Fe3+无Fe2+,氯气可能过量,过程Ⅵ的B溶液中含有的SO42,可能是氯气氧化SO2生成的,不能证明Fe3+的氧化性大于SO2;不能证明结论;
乙、过程Ⅳ的B溶液中含有的离子既有Fe3+又有Fe2+,说明氯气不足,氯气氧化性大于铁离子,过程Ⅵ的B溶液中含有的SO42,说明二氧化硫与铁离子发生了反应:2Fe3++SO2+2H2O =2Fe2++SO42-+4H+,则Fe3+氧化性大于二氧化硫;能证明结论;
丙、过程Ⅳ的B溶液中有Fe3+、无Fe2+,则氯气的氧化性大于铁离子,过程Ⅵ的B溶液中含有Fe2+,说明SO2将Fe3+还原成Fe2+,则氧化性铁离子大于二氧化硫;能证明结论;
故乙、丙一定能够证明氧化性Cl2 > Fe3+ > SO2。
(6)①FeCl2溶液加入溶液E后,溶液变为墨绿色,说明生成了FeSO3,说明E为Na2SO3(或可溶性亚硫酸盐);加入溶液F后溶液变为红棕色,放置一段 时间后变为浅绿色,说明F为FeCl3溶液。
②溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色,Fe3+ 消耗 SO32-,c(SO32-)减小,使平衡Fe2+(aq)+ SO32- (aq)![]() FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色。
FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)cH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应后生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示
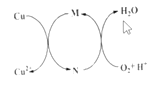
步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。下列有关说法正确的是( )
A.a、b、c之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.步骤1充分反应后,加入CuO是为了除去Fe3+
D.若制备1molCuCl2,理论上消耗11.2LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔在Pd表面选择加氢的反应机理如图所示。其中吸附在Pd表面上的物种用*标注。
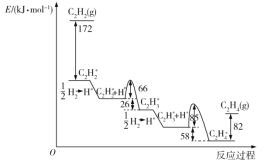
下列有关说法正确的是( )
A.该正反应历程中最大能垒(活化能)为85kJ·mol-1
B.吸附反应为吸热反应
C.Pd为固体催化剂,其表面积大小对催化效果无影响
D.C2H2*+H*→C2H3*只有化学键的形成过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不能用勒夏特列原理解释的是( )
A.对于CO(g)+NO2(g)![]() CO2(g)+NO(g)的平衡体系,增大压强可使颜色变深
CO2(g)+NO(g)的平衡体系,增大压强可使颜色变深
B.氢气和氮气合成氨的反应中,在加压下有利于氨的生成
C.开启可乐瓶,瓶中马上泛起大量气泡
D.利用排液法收集氯气时常用液体为饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个体积均为2 L恒容密闭容器中,反应CO(g)+2H2(g)![]() CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
容器编号 | 温度/K | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | ||
CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||
Ⅰ | T1 | 0.40 | 0.80 | 0 | 0.24 |
Ⅱ | T2 | 0 | 0 | 0.40 | 0.20 |
Ⅲ | T2 | a | b | ||
A.反应温度:T1<T2
B.达平衡时,转化率:α(CO,Ⅰ)+α(CH3OH,Ⅱ)>1
C.在容器Ⅲ中,若平衡时,CO的转化率大于H2,则![]()
D.在容器Ⅲ中,若起始时加入0.4 mol CO、0.4 mol H2和0.4 mol CH3OH,则此时v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:
2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4__________H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:____________________。

(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42残留,原因是__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的质量分数是________。(已知:H3PO4摩尔质量为98 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莲花清瘟胶囊对新冠肺炎轻症状患者有显著疗效,其有效成分绿原酸存在如图转化关系,下列有关说法正确的是( )
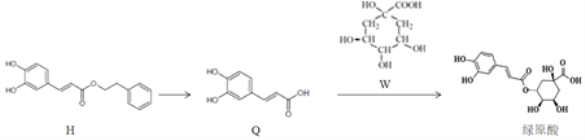
A.H的分子式为C17H14O4
B.Q中所有碳原子不可能都共面
C.绿原酸可发生加成、氧化和取代反应
D.W既属于羧酸类化合物又属于酚类化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小, Y的次外层电子数是最外层的![]() ,ZX是一种生氢剂,W与Y同一主族。下列叙述正确的是( )
,ZX是一种生氢剂,W与Y同一主族。下列叙述正确的是( )
A. 原子半径:rW>rZ>rY
B. 化合物ZX中各原子均满足8电子稳定结构
C. 由X、Y、Z、W组成的化合物的水溶液可能显酸性
D. 简单气态氢化物稳定性:W>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com