
| A、只要是氧化还原反应就可以将其设计成原电池 |
| B、在铜、锌和硫酸构成的原电池中加入少量过氧化氢可以加快速率 |
| C、精炼铜时,阴极析出铜的质量比阳极溶解的铜大 |
| D、在相同条件下,用排水法收集电解饱和食盐水产生的气体时,收集到的气体体积阴极大于阳极 |


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液 的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中由水电离出的c(H+)=1×10-3mol?L-1 |
| B、pH=2的HA溶液与pH=3的HCl溶液:c(HA)=10 c(HCl) |
| C、pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得的溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
| D、0.1mol?L-1HA溶液与0.05mol?L-1NaOH溶液等体积混合后所得的溶液中:c(A-)+c(HA)=0.05mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向正反应方向移动 |
| B、平衡常数K增大 |
| C、NO2的转化率变小 |
| D、容器内气体颜色先变深后变浅,最后比原来还要浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用铂作电极电解MgCl2溶液:2Cl-+2H2O
| ||||
B、用石墨电极电解氯化铜溶液:Cu2++2Cl-+2H2O
| ||||
C、向Ca(HCO3)2溶液中滴加少量的NaOH溶液:Ca2++HC
| ||||
| D、将少量氯气通入溴化亚铁溶液中:2Br-+Cl2═Br2+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某种核素的相对原子质量 |
| B、某种核素的近似相对原子质量 |
| C、某种元素的平均相对原子质量 |
| D、某种元素的平均相对原子质量的近似值 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3+HCl |
| B、K2CO3+H2SO4 |
| C、Na2CO3+HNO3 |
| D、(NH4)2CO3+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
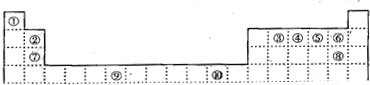
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com