
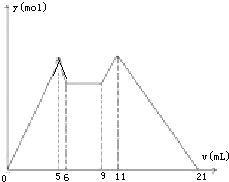
 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )| A. | A是盐酸,B是NaOH,且C(NaOH)=2C(HCl) | |
| B. | 原混合液中,C(Al3+):C(Mg2+):C(Cl-)=1:1:5 | |
| C. | A是NaOH,B是盐酸,且C(NaOH):C(HCl)=2:1 | |
| D. | 从6到9,相应离子反应式H++OH-═H2O |
分析 A.向混合溶液中加入A时立即生成沉淀,氢氧化钠和氯化镁、氯化铝生成沉淀,稀盐酸和氯化铝、氯化镁不反应,所以A是NaOH;改用B时又生成沉淀且当B过量时沉淀溶解,则B是稀盐酸;
B.根据第一次沉淀最大到最小需要的氢氧化钠的量计算铝离子的物质的量,根据需要氢氧化钠总的物质的量计算镁离子的物质的量,根据电荷守恒计算氯离子的物质的量;
C.根据铝元素守恒计算氢氧化钠与盐酸浓度的关系;
D.根据沉淀的量未发生变化确定反应实质,从而确定离子方程式.
解答 解:A.向混合溶液中加入A时立即生成沉淀,氢氧化钠和氯化镁、氯化铝生成沉淀,稀盐酸和氯化铝、氯化镁不反应,所以A是NaOH;改用B时又生成沉淀且当B过量时沉淀溶解,则B是稀盐酸,故A错误;
B.从加入5 mL A生成沉淀最多,再继续加1 mL 甲沉淀量减少到最小值,相应反应的离子方程式为:
Al(OH)3+OH-=AlO2-+2H2O,由此可知,n(Al3+)=n〔Al(OH)3〕=(1×6×10-3) mol;
由前5 mL NaOH形成最大沉淀量可知,2n(Mg2+)+3n(Al3+)=(5×10-3×6)mol,所以n(Mg2+)=(1×6×10-3) mol;溶液中阴阳离子所带电荷相等得,n(Cl-)=(5×10-3×6)mol,即溶液中c(Mg2+):c(Al3+):c(Cl-)=1:1:5,故B正确.
C.又由图可知,5→6(1 mL)、9→11(2 mL)分别是溶解Al(OH)3和使AlO2-恰好完全生成Al(OH)3沉淀消耗的NaOH和HCl.根据铝元素守恒:
NaOH-Al(OH)3-AlO2--H+
1 1 1 1
由此可以推出:c(NaOH):c(HCl)=2:1,故C正确.
D、由6mL和9mL对应液体中沉淀量相等,可以推知此时仅仅发生酸碱中和反应,即H++OH-=H2O,故D正确;
故选A.
点评 本题考查混合物的有关计算,侧重考查学生分析计算能力,明确各个阶段发生的反应是解本题关键,熟悉各个物理量之间的关系,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
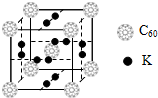 氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.根据要求回答有关问题:
氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.根据要求回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
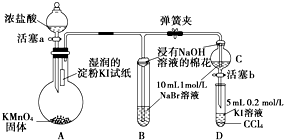 实验题为验证卤素单质氧化性的强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验).
实验题为验证卤素单质氧化性的强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向1mol•L-1的氨水中加少里硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 物质的量浓度相等的①(NH4)2SO4溶液②NH4HCO3溶液③NH4Cl溶液④(NH4)2Fe(SO4)2溶液液中,c(NH${\;}_{4}^{+}$)的大小关系:④>①>③>② | |
| C. | 将2mol•L-1的某一元酸HA溶液和1mol•L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(HA) | |
| D. | 物质的量浓度之比为 1:1 的NaClO、NaHCO3混合溶液中:c(HC10)+c(ClO-)=c(C0${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com