
工业上用活性炭吸附海带提碘后废水中的I-制取I2,其流程如下图:
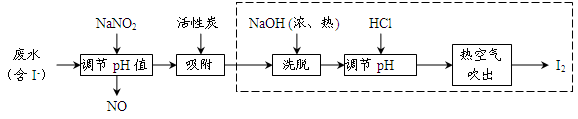
(1)向废水中加入NaNO2并调节pH<4,写出反应的离子方程式__________________。
(2)用活性炭吸附生成的单质碘的目的是__________________________,用浓、热NaOH洗脱吸附的碘的化学方程式为___________________________________。
(3)从调节pH后所得的溶液中获取碘,工业上可用热空气吹出,其原因是___________;若取少量该溶液在实验室中分离得到单质碘,需要进行的操作为__________________。
(4)流程中生成的NO尾气有毒,工业上将其与O2按一定比例通入NaOH制备NaNO2,写出反应的化学方程式:________________________________。
(5)工业上虚框内流程还可用如图操作代替,评价下图流程的优点___________________________(写出一条)。
(1)2NO2-+ 4H++ 2I- → 2NO + I2 + 2H2O (2分)
(2)富集单质碘(1分) 3I2 + 6NaOH → NaIO3+ 5NaI+ 3H2O(2分)
(3)单质碘在水中溶解度小,易升华(1分) 萃取 分液 蒸馏(3分)
(4)4NaOH+ O2+ 4NO → 4NaNO2+ 2H2O(2分)
(5)减少了化学药品的投入量,使成本大大降低。(或生产环节减少;或药品对设备无腐蚀性等)(1分,合理即可)
【解析】
试题分析:(1)根据流程图信加入NaNO2时有NO生成,发生了氧化还原反应,故其离子方程式2NO2-+ 4H++ 2I- → 2NO + I2 + 2H2O。
(2)用活性炭吸附生成的单质碘的目的是富集单质碘。根据流程图最后加入酸时又有碘生成,可知用浓、热NaOH洗脱吸附的碘的化学方程式为3I2 + 6NaOH → NaIO3+ 5NaI+ 3H2O。
(3)从调节pH后所得的溶液中获取碘,工业上可用热空气吹出,其原因是单质碘在水中溶解度小,易升华;若取少量该溶液在实验室中分离得到单质碘先后进行的操作为 萃取、分液、蒸馏。
(4)根据氧化还原反应原理,反应的化学方程式4NaOH+ O2+ 4NO → 4NaNO2+ 2H2O。
(5)从能源的利用和环保方面思考做答,可以是减少了化学药品的投入量,使成本大大降低。(或生产环节减少;或药品对设备无腐蚀性等)
考点:本题考查离子方程式的书写,物质的提纯和实验方案的评价。


科目:高中化学 来源: 题型:阅读理解
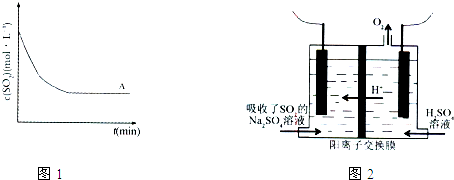
| 方法1 | 用氨水将SO2转化为(NH4)2SO3,再氧化成(NH4)2SO4 |
| 方法2 | 用活性炭吸附法处理SO2 |
| 方法3 | 用Na2SO4溶液吸收SO2,再进行电解得到S单质 |
| t(min) 浓度(mol?L-1) |
0min | 1min | 2min | 3min | 4min | 5min | 6min |
| c(SO2) | 0.054 | 0.034 | 0.018 | 0.010 | 0.008 | 0.006 | 0.006 |
| c(O2) | 0.032 | 0.022 | 0.014 | 0.010 | 0.009 | 0.008 | 0.008 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②③⑤ | C、②③④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源:2014届浙江省湖州市八校高三上学期第二次联考化学试卷(解析版) 题型:实验题
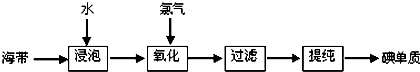
【材料一】苏教版《化学1(必修)》工业上从海产品(海带)中获取碘的流程图如下:

(1)上述生产流程的第一步是“浸泡”,它的实验目的是 ;
(2)“氧化”这一操作中可供选用的试剂:Cl2 、Br2、浓硫酸和H2O2(滴加稀硫酸),从无污染角度考虑,请你选择的合适试剂 ;
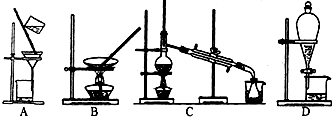
(3)上述的生产流程中,“提纯获得单质碘”一般认为经历两步,你认为应选择下图实验装置分别是( )( ) (按操作的先后顺序填写);



 【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:

(4)实际工业生产中,酸化、氧化的方法是先加入硫酸酸化,使pH降低到2,然后加入次氯酸钠一类的氧化剂,使碘离子氧化。工业通常不用氯气氧化原因是(用离子方程式表示)
;
(5)上述的生产流程中离子交换树脂是用碱性树脂吸附,再用亚硫酸钠一类还原剂解吸,请问树脂吸附的碘元素状态是 (填写“游离态”或“化合态”)。解吸后应加入 (填写下列编号:A.氧化剂、B.还原剂)可以实现碘析。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com