
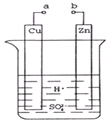
 原电池是化学对人类的一项重大贡献.
原电池是化学对人类的一项重大贡献. | 0.2mol |
| 2 |


科目:高中化学 来源: 题型:
| A、一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
| B、乙烷和丙烯的物质的量共1mol,完成燃烧生成3mol H2O |
| C、用水可区分苯和溴苯 |
D、如图中有机物的一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液 |
| B、Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即有气体产生 |
| C、Na+、Al3+、Cl-、SO42- 逐滴滴加NaOH先有沉淀产生,后沉淀消失 |
| D、NH4+、Mg2+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻又气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(CO2) |
| n(H2) |
| 设备编号 | c(CO2) /mol?L-1 | c(H2) /mol?L-1 | c(CH3OCH3) /mol?L-1 | c(H2O) /mol?L-1 | v(正)和v(逆)比较 |
| Ⅰ | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v(正)=v(逆) |
| Ⅱ | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、构成原电池正极和负极的材料必须是两种金属 |
| B、由铜锌作为电极与硫酸铜溶液组成的原电池中,铜是负极 |
| C、电流通过硫酸溶液,SO42-向正极移动 |
| D、铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com