
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源:2012年苏教版高中化学选修2 1.2硬水软化练习卷(解析版) 题型:填空题
某自来水中含有Ca2+、Mg2+、Na+、K+、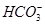 、
、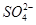 、Cl-,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉、引起爆炸的危险,因此要定期清除锅炉水垢。已知部分物质20 ℃时的溶解度数据为
、Cl-,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉、引起爆炸的危险,因此要定期清除锅炉水垢。已知部分物质20 ℃时的溶解度数据为
|
物质 |
Mg(OH)2 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
CaSO4 |
MgSO4 |
|
溶解度 g/100 g H2O |
9.0×10-4 |
1.5×10-3 |
1.0×10-2 |
1.7×10-1 |
2.1×10-1 |
26.7 |
(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:
________________________________________________________________________
________________________________________________________________________。
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去。试剂X是____________。(填序号)
A.NaOH B.NaHCO3
C.Na2CO3 D.NaCl
CaSO4能转化为物质Y的原因是(用文字叙述)_______________________________________
________________________________________________________________________。
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)_________________ _______________________________________________________。
(4)若所用自来水的硬度为33.6度(计算硬度是将Ca2+、Mg2+都看成Ca2+,并将其折算成相当于CaO的质量,通常1 L水中含有10 mg CaO称为1度)。1 t这样的水中相当于含CaO的物质的量为__________(水的密度为1 g/cm3)。
(5)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应。现取含Ca2+浓度为0.40 g/L的自来水样10 mL至锥形瓶中进行滴定,达到滴定终点时,用去了浓度为0.01 mol/L的M溶液20.00 mL,则该自来水样中Mg2+的物质的量浓度是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com