
【题目】(1)金属钠是一种非常活泼的金属,通常保存________中。把钠投入硫酸铜溶液中,发生反应的离子方程式为__________、_______。
(2)有一透明溶液,可能含有![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 等离子中的一种或几种。现加入
等离子中的一种或几种。现加入![]() 粉末有无色无味的气体放出,同时析出白色沉淀。假设溶液中的水足量,加入
粉末有无色无味的气体放出,同时析出白色沉淀。假设溶液中的水足量,加入![]() 的量与生成白色沉淀的量之间的关系如图来表示。试推断:
的量与生成白色沉淀的量之间的关系如图来表示。试推断:
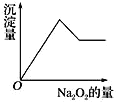
①原溶液中一定含有的离子是_________________;
②一定不含有的离子是________________;
③可能含有__________;为了进一步确定可能含有该离子,可增加焰色反应的实验,透过蓝色钴玻璃观察到的火焰的颜色为______色。
【答案】煤油 2Na + 2H2O=2Na++2OH- + H2↑ Cu2++2OH-═Cu(OH)2↓ Mg2+、Al3+ Fe3+、Cu2+ K+ 紫
【解析】
(1)钠常温下能与O2、H2O等物质反应,所以应该密封保存;钠投入硫酸铜溶液中,钠先与水反应生成氢氧化钠和氢气,然后铜离子与氢氧化钠溶液反应生成氢氧化铜沉淀,据此分析解答;
(2) 根据析出白色沉淀判断Fe3+、Cu2+是否存在,根据图像先生成白色沉淀,后沉淀部分溶解,判断Mg2+、Al3+是否存在,据此分析解答。
(1)钠常温下能与O2、H2O等物质反应,所以应该密封保存,钠通常密封保存于煤油中;钠投入硫酸铜溶液中,钠先与水反应生成氢氧化钠和氢气,然后铜离子与氢氧化钠溶液反应生成氢氧化铜沉淀,反应的离子方程式为:2Na + 2H2O=2Na++OH- + H2↑、Cu2++2OH-═Cu(OH)2↓,故答案为:煤油;2Na + 2H2O=2Na++OH- + H2↑;Cu2++2OH-═Cu(OH)2↓;
(2) 加入Na2O2粉末,过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,并同时析出白色沉淀,因此不含有铁离子和铜离子;可以含有Al3+、Mg2+中的一种或两种;当加入过量的过氧化钠时,先生成白色沉淀,后沉淀部分溶解,推断一定有Mg2+、Al3+,可能含有K+;
①原溶液中一定含有的离子是Al3+、Mg2+,故答案为:Al3+、Mg2+;
②原溶液中一定不含有的离子是Fe3+、Cu2+,故答案为:Fe3+、Cu2+;
③原溶液中可能含有K+;为了进一步确定可能含有该离子,用洁净的铂丝蘸取待测液,在酒精灯上灼烧,透过蓝色钴玻璃观察火焰的颜色,火焰呈紫色,说明含有K+,故答案为:K+;紫。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】烃A是一种植物生长的调节剂,A进行如图所示的转化可制得有果香味的液体E(C4H8O2)。请回答下列问题:
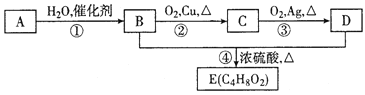
(1)A的电子式为___,D分子中所含官能团的名称为___。
(2)反应①的反应类型是____。
(3)A在一定条件下可以聚生成一种常见塑料,写出该塑料的结构简式___。
(4)请写出反应②的化学方程式__。
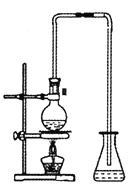
(5)实验室出反应④制备有机物E的装置如图,长导管的作用是导气和___,锥形瓶中盛放的液体是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物(分子式为C13H18O2)是一种食品香料,其合成路线如图所示。
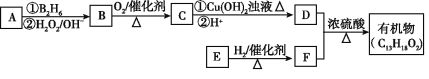
已知:R-CH=CH2![]() R-CH2CH2OH
R-CH2CH2OH
通过质谱法测得A的相对分子质量为56,它的核磁共振氢谱显示有两组峰且峰面积之比为1∶3;D分子中含有支链;F分子中含有苯环但无甲基,在催化剂存在下1molE与2molH2可以发生反应生成F。请回答:
(1)B中所含官能团的名称为___;E的结构简式为___。
(2)C与新制悬浊液反应的离子方程式为___。
(3)D与F反应的化学方程式为___;其反应类型是___。
(4)符合下列条件:①遇FeCl3溶液显紫色、②苯环上有两个取代基的F的同分异构体有___种,写出其中一种物质的结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 22.4LCl2溶于足量水,所得溶液中Cl2、Cl-、HClO和ClO-四种微粒总数为NA
B. 标准状况下,38g3H2O2中含有3NA共价键
C. 常温下,将5.6g铁块投入足量浓硝酸中,转移0.3NA电子
D. 0.1molL-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向苯酚钠溶液中通入少量CO2:2C6H5O![]() +CO2+H2O→2C6H5OH+CO32-
+CO2+H2O→2C6H5OH+CO32-
B. NH4HSO3溶液与足量NaOH溶液反应:HSO![]() +OH-=SO32-+H2O
+OH-=SO32-+H2O
C. Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+=Fe2++2H2O
D. H218O2中加入H2SO4酸化的KMnO4:5H218O2+2MnO![]() +6H+= 518O2+2Mn2++8H2O
+6H+= 518O2+2Mn2++8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
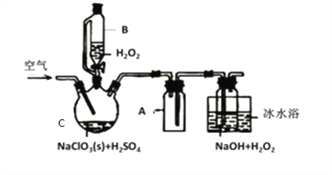
(1)仪器C的名称是__________________,仪器A的作用是_________________,冰水浴冷却的目的是_____________________和___________________________。
(2)该装置不完善的方面是________________________。
(3)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,___________;空气流速过快时,________________。
(4)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①_____________________________(用离子方程式表示)
②H2O2+Cl2=2Cl-+O2+2H+
(5)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__________________________,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为_________________。(M(NaClO2)=90.5g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的二氧化锰与40 mL 10 mol/L浓盐酸反应产生的氯气同0.1 mol二氧化锰与足量的浓盐酸反应产生的氯气相比( )
A. 前者产生的Cl2多 B. 后者产生的Cl2多
C. 一样多 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
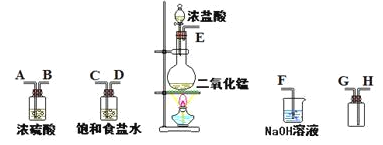
(1)连接上述仪器的正确顺序是(填各接口处的字母):E接 , 接 , 接 , 接 。___
(2)在装置中饱和食盐水起的作用是___。
(3)化学实验中检验是否有Cl2产生常用试纸为___。
(4)写出氢氧化钠溶液中反应的离子方程式___。
(5)将0.2molMnO2和500mL12mol/L盐酸混合后缓缓加热,MnO2反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀的物质的量为___(不考虑盐酸的挥发和氯气的溶解)。
(6)实验室也可以用K2Cr2O7和盐酸反应制取Cl2,配平反应方程式,并指出氧化剂和还原剂的物质的量之比是___,________K2Cr2O7+________HCl=________KCl+________CrCl3+________Cl2↑+________H2O
(7)已知还原性:SO32->I-。向含amolKI和amolK2SO3的混合液中通入bmolCl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是___
A.当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl-
B.当5a=4b时,发生的离子反应为4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl-
C.当a<b<![]() 时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b
时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b
D.当a≤b≤![]() 时,反应中转移电子的物质的量n(e-)为amol≤n(e-)≤3amol
时,反应中转移电子的物质的量n(e-)为amol≤n(e-)≤3amol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com