
|
将7.8 g铁加入到200 mL 2 mol·L-1的HNO3溶液中,充分反应后,溶液中主要离子的浓度关系是( ). | |
A. |
c(NO3-)>c(Fe2+)>c(Fe3+)>c(H+) |
B. |
c(NO3-)>c(Fe3+)>c(Fe2+)>c(H+) |
C. |
c(Fe2+)>c(Fe3+)>c(NO3-)>c(H+) |
D. |
c(Fe2+)>c(NO3-)>c(Fe3+)>c(H+) |
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| 11m-3b |
| 11m |
| 11m-3b |
| 11m |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度(℃) | 60 | 240 | 930 | 1000 |
| 残留固体质量(g) | 19.7 | 16.1 | 8.1 | 8.1 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省信阳市毕业班第二次调研考试化学试卷 题型:填空题
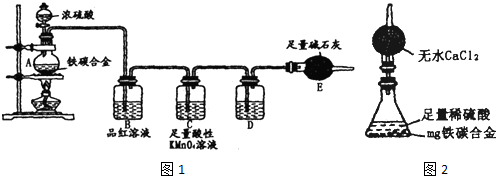
(16分)某校化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
I、探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量。

(2)将m g铁碳合金样品放入A中,再加入适量的浓硫酸。未点燃酒精灯前,A、B容器中均无明显现象,其原因是:___________________________________。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式________________、____________________。
(4)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_________________________________________________。
Ⅱ、测定铁的质量分数
(5)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。则铁碳合金中铁的质量分数为_________________________(用含m、b的表达式表示)。
(6)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、H2O进入E管使b增大。你认为改进的方法是_________________。
(7)乙同学认为,即使甲同学认为的偏差得到改进,依据此实
验测得合金中铁的质量分数也可能会偏高。你认为其中的原因
是__________________。
(8)某同学认为上述方法较复杂,使用下图所示的装置和其他
常用实验仪器测定某些数据即可。为了快速准确的计算出铁的
质量分数,最简便的实验操作是_____________(填写代号)。

A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、干燥、称量残渣的质量
C.测定反应前后装置和药品的总质量
查看答案和解析>>
科目:高中化学 来源: 题型:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
⑴工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程
式是: 。
不采用铜跟浓硫酸反应来制取硫酸铜的原因是
。
⑵在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180 mL。
⑶若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 。
⑷将8 g Fe2O3投入到150 mL某浓度的稀硫酸中,再投入7 g铁粉,充分反应后,收集到1.68 L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。则原硫酸的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com