


科目:高中化学 来源: 题型:
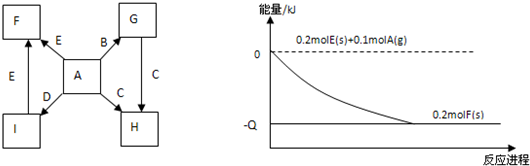
查看答案和解析>>
科目:高中化学 来源: 题型:
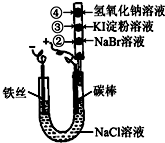 某化学兴趣小组按如图所示的装置进行实验,玻璃管内装有滴有不同溶液的白色棉球.实验过程中,两极均有气体生成.则下列说法错误的是( )
某化学兴趣小组按如图所示的装置进行实验,玻璃管内装有滴有不同溶液的白色棉球.实验过程中,两极均有气体生成.则下列说法错误的是( )| A、碳棒的电极反应式为2Cl--2e-=Cl2↑ | ||||
| B、②处、③处白色棉球分别变为橙黄色、蓝色 | ||||
C、如图X、Y两条线分别表示常见的非金属单质和金属单质(用M表示)与碳棒电解产物单质E在点燃条件下进行化合反应的物质的量之间的关系.写出符合Y线反应的化学方式Mg+Cl2
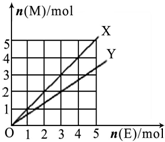 | ||||
| D、在20℃时饱和食盐水的质量分数为26%,当阳极析出1.12L(标准状况下)气体时,Cl-完全放电.试计算要使溶液恢复原状态,需加入3.65gHCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
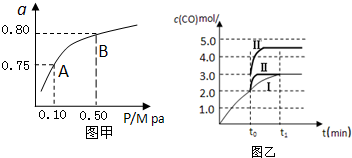
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| A、催化脱氢反应中NH3BH3作氧化剂 |
| B、NH4BO2和NH3BH3含有完全相同的化学键 |
| C、0.1 mol NH3BH3发生催化脱氢反应,可以生成6.72 L H2 |
| D、元素N的第一电离能高于相邻元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上电解NO制备 NH4NO3,其工作原理如图所示,电解时阳极的电极反应为
工业上电解NO制备 NH4NO3,其工作原理如图所示,电解时阳极的电极反应为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷是烃类物质中相对分子质量最小的物质 |
| B、1molCH4在光照条件下最多能与4molCl2反应 |
| C、甲烷的二氯代物只有一种可以证明甲烷为正四面体结构 |
| D、甲烷与空气的体积比为1:2时,混合气点燃爆炸最剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| B、2.8gN2和2.24 LCO组成的混合物中质子数为1.4 NA |
| C、将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中一定含有NA个NH4+ |
| D、25℃时,1LpH=13的 Ba(OH)2溶液中含有的OH-数目为0.2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com