
【题目】(1)在25 ℃、101 kPa的条件下,

请回答下列有关问题:
①由H+H→H2,当生成1 mol H2时,要________(填“吸收”或“放出”,下同)436 kJ的能量;由Cl2→Cl+Cl,当断裂1 mol Cl2中的共价键时,要________243 kJ的能量。
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是________kJ。
③有两个反应:a.H2(g)+Cl2(g)![]() 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)![]() 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
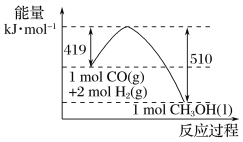
(2)根据图示的能量转化关系判断,生成16 g CH3OH(l)________(填“吸收”或“放出”)________kJ能量。
【答案】放出 吸收 431 相等 放出 45.5
【解析】
(1)①断开建吸收能量,成键需要释放能量;
②根据焓变=反应物总键能-生成物总键能;
③根据盖斯定律,反应热与反应条件无关,只与始态和终态有关;
(2)根据图示,反应物总能量高于生成物总能量,反应放出或吸收的能量与参与反应的物质的物质的量成正比。
(1)①断开建吸收能量,成键需要释放能量,由H+H→H2,是成键过程,释放能量,当生成1 mol H2时,要放出436 kJ的能量;由Cl2→Cl+Cl,是断键过程,断键吸收能量,当断裂1 mol Cl2中的共价键时,要吸收243 kJ的能量;
②根据焓变=反应物总键能-生成物总键能,断裂1molH-H键与1molCl-Cl键吸收的能量之和,即436kJ+243kJ=679kJ,设断开1molH-Cl键吸收的总能量为E(H-Cl),则有( 436kJ+243kJ) -2×E(H-Cl) =-183kJ,则E(H-Cl)=431kJ;
③两个反应的能量转化形式主要是化学能转化为热能,一个具体的反应释放能量的多少与反应条件无关,而与断开旧化学键和形成新化学键的能量变化有关,所以生成等量的产物所释放的能量相等;
(2)根据图示变化可知,反应物总能量高于生成物总能量,该反应属于释放能量的反应,生成1mol CH3OH(l)放出的能量为510kJ-419kJ=91kJ,16gCH3OH的物质的量为0.5mol,故生成16g CH3OH(l)放出的热量为45.5kJ。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在不同条件下分别测得反应2SO2+O2![]() 2SO3的化学反应速率,其中表示该反应进行最快的是( )
2SO3的化学反应速率,其中表示该反应进行最快的是( )
A. v(SO2)=4 mol·L-1·min-1B. v (O2)=3 mol·L-1·min-1
C. v (SO3)="0.1" mol·L-1·s-1D. v (O2)=0.1mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取SO 2并验证SO 2的某些性质的装置,请回答:
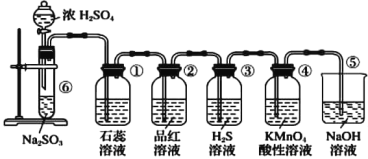
(1)在⑥中发生反应的化学方程式为_____________________。
(2)①中的实验现象为石蕊溶液__________,此实验证明SO 2具有_________的性质。
(3)②中的品红溶液________。
(4)③中发生的化学反应方程式为________________。
(5)④中的实验现象是______________________,证明SO 2有_____________性。
(6)⑤装置的作用是_________,该反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Ⅰ:CaSO4(s)+ CO(g) ![]() CaO(s)+SO2(g)+CO2(g) ΔH=+218.4 kJ·mol-1反应Ⅱ:CaSO4(s)+4CO(g)
CaO(s)+SO2(g)+CO2(g) ΔH=+218.4 kJ·mol-1反应Ⅱ:CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) ΔH=-175.6 kJ·mol-1假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是
CaS(s)+4CO2(g) ΔH=-175.6 kJ·mol-1假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是
A.  B.
B. 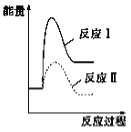 C.
C.  D.
D. 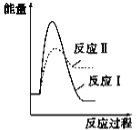
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
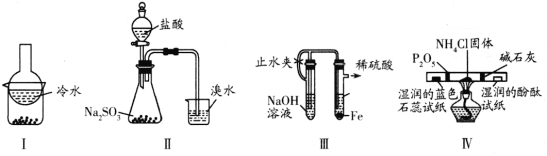
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锌碘液流电池具有能量密度高、循环寿命长等优势,其工作原理如图所示。下列说法错误的是

A. 放电时电流从石墨电极流向锌电极
B. 充电时阳极反应式为:3I--2e-=I3-
C. 若将阳离子交换膜换成阴离子交换膜,放电时正负极也随之改变
D. 放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是
A. 饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
B. 25℃时,FeS的溶解度大于CuS的溶解度
C. 向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D. 向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季我国北方大部分地区出现雾霾天气,引起雾霾的微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物、扬尘、重金属铜等。
(1)N元素原子核外电子云的形状有___种;基态铜原子的价电子排布式为___。
(2)N和O中第一电离能较小的元素是__;SO42-的空间构型___。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为___,H2O2难溶于CC14,其原因为___。
(4)PM2.5富含NO,NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为___。
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设NA为阿伏加德罗常数的值,晶胞边长为540pm,则该晶体的密__g/cm3(只列式不计算,Kr摩尔质量为84g·mol-1)。
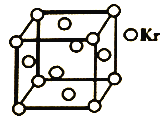
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液 A中可能含有如下离子:Na+、NH4+、Ba2+、Mg2+、SO42-、SO32-、Cl-、OH-。某同学设计并完成了如下的实验:
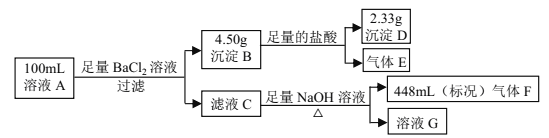
下列说法正确的是
A. 溶液 A 中一定存在 NH4+、 SO42-、 SO32-,可能存在 Na+
B. 溶液 A 中一定存在 NH4+、 Mg2+、 SO42-、 SO32-,可能存在 Cl-
C. 溶液 A 中可能存在 Cl-,且 c(Na+) ≥ 0.20 mol·L-1
D. 如果气体 F 能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有 NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com