
| A. | ①②④⑥ | B. | ⑤⑥⑦⑨ | C. | ①⑤⑥⑦⑨ | D. | ②③④ |
分析 化学变化的特征是:在原子核不变的情况下,有新物质生成.判断物理变化和化学变化的依据是:是否有新物质生成.
解答 解:①木材干馏制焦炭,木材中的C元素是以化合态存在的,制取焦炭属于化学变化,故①正确;
②甘油加水作护肤剂,利用的是甘油的物理性质,故②错误;
③将溴水滴入CCl4中振荡后褪色,是萃取,利用的是物质的溶解度,故③错误;
④蛋白质水溶液中加入浓硫酸铵有沉淀析出,此属于蛋白质的变性,属于化学变化,故④正确;
⑤用福尔马林溶液浸泡动物的尸体,利用的是甲醛的化学性质,故⑤正确;
⑥烹鱼时加入少量的料酒和食醋可减少腥味,增加香味,有酯类物质生成,属于化学变化,故⑥正确;
⑦Na2CO3•10H2O在干燥空气中失水,属于化学变化,故⑦正确;
⑧在Fe(OH)3胶体中加入硅酸溶胶而出现沉淀,此属于胶体的聚沉,无新物质生成,故⑧错误;
⑨电解饱和食盐水制H2、Cl2、NaOH,有新物质生成,属于化学变化,故⑨正确,故选C.
点评 本考点考查了物理变化和化学变化的区别,基础性比较强,只要抓住关键点:是否有新物质生成,问题就很容易解决,本考点主要出现在选择题和填空题中.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 要配制浓度为0.25mol•L-1的NaOH溶液480mL,应称量4.8g NaOH在250mL的烧杯中溶解,冷却,再转移到500mL容量瓶中,洗涤、转移、定容 | |
| B. | 配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏低 | |
| C. | 配制一定物质的量浓度的溶液定容时,俯视刻度线导致所配浓度偏高 | |
| D. | 配制20g密度为ρg•cm-3的Ca(NO3)2溶液中含有2g Ca(NO3)2,则溶液中NO3-的物质的量浓度为25ρ/41mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
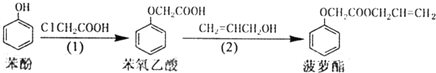
| A. | 步骤(1)、(2)的反应类型不同 | |
| B. | 步骤(1)产物中残留的苯酚能用FeCl3溶液检验 | |
| C. | 苯氧乙酸和菠萝酯均可与氢氧化钠溶液反应 | |
| D. | 步骤(2)产物中残留的烯丙醇不能用溴水检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
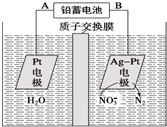
| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 该电解池的总反应方程式为:2H2O+4NO3- $\frac{\underline{\;电解\;}}{\;}$2N2↑+5O2↑+4OH- | |
| C. | 该电解池的阴极反应式为:2NO3-+12H++10e-═N2↑+6H2O | |
| D. | 若电解过程中转移2mol电子,则交换膜右侧电解液的质量减少5.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若改变影响化学平衡的条件之一,平衡向能够使这种改变减弱的方向移动 | |
| B. | 达到化学平衡时,各组分的浓度不再改变,反应停止 | |
| C. | 化学平衡移动,化学平衡常数不一定改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 它们的原子序数B>A>C | B. | 它们的离子半径A2->C->B2+ | ||
| C. | 它们的原子半径C>B>A | D. | 它们的最外层电子数C>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
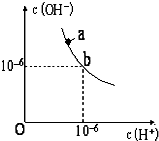 回答下列问题.
回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
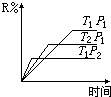 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )| A. | 正反应吸热,S是气体 | B. | 正反应吸热,S是固体 | ||
| C. | 正反应放热,S是气体 | D. | 正反应放热,S是固体或液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com