
| ��ѧʽ | CH3COOH | H2CO3 | HClO |
| ����ƽ�ⳣ��K1 | 1.8��10-5 | 4.3��10-7 | 3.0��10-8 |
| K2 | -- | 5.6��10-11 | -- |
���� ��1��CH3COOH��Һ��ˮϡ���̣��ٽ����룬n��H+���������Լ���c��H+����С��c��OH-������Kw���䣻
��2��������������ʣ���ˮϡ�ʹٽ�������룻������м�������ƹ��壬��Һ�д��������Ũ���������ƴ�����룻
��3��pH��ȵĴ�������ᣬ�����Ũ�ȴ������ᣬ�������pH�������ᣬ��������ʵ����������ᣬ������ʵ���Խ����Ҫ��Ũ�ȵ�����������Һ���Խ��
��4������ƽ�ⳣ��Խ����ĵ���̶�Խ����Һ����Խǿ�����ݱ������ݿ�֪��������ǿ������˳��Ϊ��CH3COOH��H2CO3��HClO��HCO3-������Խ������Ӧ��������ӽ�������ӵ�����Խǿ���ݴ˽��н��
��5��pH=2������ϡ��10n����pH����n��99mL0.01mol/L��������Һ��1mL1mol/L��NaOH��Һ�����Һ�Լ��ԣ�
��� �⣺��1��A��CH3COOH��Һ��ˮϡ���̣��ٽ����룬c��H+����С����A��ѡ��
B��$\frac{c��{H}^{+}��}{c��C{H}_{3}COOH��}$=$\frac{n��{H}^{+}��}{n��C{H}_{3}COOH��}$����ϡ�����б�ֵ���Bѡ��
C��ϡ���̣��ٽ����룬c��H+����С��c��OH-������c��H+��•c��OH-��=Kw��Kw���䣬��C��ѡ��
D��ϡ���̣��ٽ����룬c��H+����С��c��OH-��������$\frac{c��O{H}^{-}��}{c��{H}^{+}��}$���Dѡ��
�ʴ�Ϊ��BD��
��2��������������ʣ���ˮϡ�ʹٽ�������룬���Դ������ƽ��������Ӧ�����ƶ���������м�������ƹ��壬��Һ�д��������Ũ���������ƴ�����룬��������Ũ�ȼ�С���������Ũ����������c��H+��/c��CH3COOH����С���ʴ�Ϊ�����ң���С��
��3��pH��ȵĴ�������ᣬ�����Ũ�ȴ������ᣬ�������pH�������ᣬ��������ʵ����������ᣬ������ʵ���Խ����Ҫ��Ũ�ȵ�����������Һ���Խ������V���ף���V���ң����ʴ�Ϊ������
��4������ƽ�ⳣ��Խ����ĵ���̶�Խ����Һ����Խǿ�����ݱ������ݿ�֪��������ǿ������˳��Ϊ��CH3COOH��H2CO3��HClO��HCO3-������Խ������Ӧ��������ӽ�������ӵ�����Խǿ������������������ǿ��ΪCO32-����ѡB���ʴ�Ϊ��B��
��5��pH=2������ϡ��10n����pH����n������ȡ����Һϡ��100����pHΪ4��99mL0.01mol/L��������Һ��1mL1mol/L��NaOH��Һ��ϣ���Һ�Լ��ԣ�c��OH-��=$\frac{1��1-99��0.01}{100}$mol/L=10-4mol/L��pH=10���ʴ�Ϊ��4��10��
���� ���⿼���˵���ƽ�ⳣ��������ǿ���Ĺ�ϵ��ǿ����ʵĵ���ƽ�⼰��Ӱ���֪ʶ����Ŀ�Ѷ��еȣ�ע����ȷ������ʵĵ���ƽ�⼰��Ӱ�����أ���ȷ����ϵĶ����жϷ�����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ˮբ����������������ӵ�����������������ֹ������ʴ | |
| B�� | ��ӦSO2��g��+2H2S��g��=3S��S��+2H2O��l���ڳ��������Է����У���÷�Ӧ�ġ�H��0 | |
| C�� | 0.1mol•L-1��CH3COOH��Һ��ˮϡ�ͣ���Һ��pH����Һ��ˮ�ĵ���̶Ⱦ����� | |
| D�� | �����£���������������ʵ���Ũ�ȵ�NaHCO3��NaCl��Һ��ϣ���������NaHCO3���壬���ˣ�������ҺpH��7������KW/c��H+����1.0��10-7 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2H2+O2$\frac{\underline{\;��ȼ\;}}{\;}$2H2O | B�� | CO2+H2O�TH2CO3 | ||
| C�� | Fe+H2SO4=FeSO4+H2�� | D�� | MgCO3+2HCl�T2HCl2+CO2��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
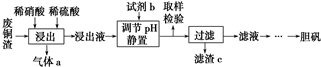

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �ı�������ȷ���ǣ�������
�ı�������ȷ���ǣ�������| A�� | �������ܷ����ӳɡ�ȡ����������Ӧ | |
| B�� | ��������FeC13��Һ��ɫ��lmol��������Ũ��ˮʱ�����1mo1Br2����ȡ����Ӧ | |
| C�� | �����ʵķ���ʽΪC11H14O3 | |
| D�� | 1mol�������������Na��NaOH��NaHC03�����ʵ���֮��Ϊ2��2��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
| X | ��������Ԫ�صļ������а뾶��С |
| Y | ������⻯�����ˮ��Һ�ʼ��� |
| Z | ԭ�Ӻ��������������������� |

 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Va=Vb | B�� | Va��Vb | C�� | Va��Vb | D�� | ����ȷ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com