
| A. | 用BaCl2溶液鉴别Na2CO3和Na2SO4溶液 | |
| B. | 用淀粉溶液检验食盐中是否添加KIO3 | |
| C. | 用焰色反应并透过蓝色钴玻璃检验NaCl中是否混有KCl | |
| D. | 用溴水鉴别乙烯和二氧化硫两种气体 |
分析 A.二者均与氯化钡反应生成白色沉淀;
B.淀粉遇碘单质变蓝;
C.焰色反应为元素的性质,观察K的焰色反应为紫色,透过蓝色的钴玻璃观察;
D.乙烯和二氧化硫均与溴水反应,溴水褪色.
解答 解:A.二者均与氯化钡反应生成白色沉淀,现象相同,不能鉴别,故A错误;
B.淀粉遇碘单质变蓝,则不能检验食盐中是否添加KIO3,故B错误;
C.焰色反应为元素的性质,观察K的焰色反应为紫色,透过蓝色的钴玻璃观察,则用焰色反应并透过蓝色钴玻璃检验NaCl中是否混有KCl,故C正确;
D.乙烯和二氧化硫均与溴水反应,溴水褪色,现象相同,不能鉴别,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、物质的鉴别、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
吸热反应C+CO2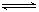 2CO反应速率为 ?1,放热反应N2+3H2
2CO反应速率为 ?1,放热反应N2+3H2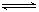 2NH3反应速率为 ?2,对于上述反应,当温度升高时,?1和
2NH3反应速率为 ?2,对于上述反应,当温度升高时,?1和 ?2的变化情况为? ?
?2的变化情况为? ?
A.同时增大  B.同时减小
B.同时减小
C.增大,减小 D.减小,增大
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| A. | 5.7×10-18 mol•L-1 | B. | 2.6×10-5mol•L-1 | ||
| C. | 1.6×10-13mol•L-1 | D. | 5.7×10-24mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=5的CH3COOH溶液稀释100倍 | |
| B. | 0.05mol/L H2SO4与0.10mol/L NaOH溶液以等体积混合 | |
| C. | pH=2的盐酸和pH=12的氨水两种溶液以等体积混合 | |
| D. | pH=1的H2SO4与0.10mol/L 的Ba(OH)2溶液以等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0,说明金刚石比石墨稳定 | |
| B. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.4kJ/mol,则含20.0gNaOH的稀溶液与稀醋酸完全中和,放出热量小于28.7kJ | |
| C. | 已知甲烷的燃烧热为890.3kJ/mol,则表示甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| D. | 将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸中的HNO3见光会分解,因此有时在实验室看到的浓硝酸呈黄色 | |
| B. | SO2具有漂白性,因此可使溴水褪色 | |
| C. | Na的金属性比Cu强,因此可用Na与CuSO4溶液反应制取Cu | |
| D. | Fe在Cl2中燃烧生成FeCl3,因此在与其他非金属反应的产物中Fe也显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;CCH3OH;D
;CCH3OH;D ;ECH3COOH.
;ECH3COOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| c(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A. | 容器甲中的反应在前2min的平均速率v(SO2)=0.05mol•L-1•min-1 | |
| B. | 达到平衡时,容器丙中正反应速率与容器甲相等 | |
| C. | 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0 | |
| D. | 容器乙中若起始时改充0.10mol•L-1NO2和0.20mol•L-1SO2,达到平衡时c(NO)与原平衡不相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com