
随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止副食品氧化变质,延长食品的保质期,在包装袋中常放入抗氧化物质。下列不属于抗氧化物质的是
A.生石灰 B.亚硫酸钠(Na2SO3) C.铁粉 D.硫酸亚铁(FeSO4)
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源:2017届山西省晋商四校高三上11月联考化学试卷(解析版) 题型:选择题
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | SO2分别通入BaCl2和Ba(NO3)2溶液中 | 均有白色沉淀产生 | 沉淀成分为BaSO3 |
B | 试液中滴加双氧水和硫氰化钾溶液 | 溶液变红 | 试液中一定含有Fe2+ |
C | 把混有少量NaCl的蛋白质溶液放入半透膜袋中,进行渗析,取少量袋内液体,加硝酸酸化的AgNO3进行检验 | 产生白色沉淀 | 胶体和离子 |
D | 向含有少量Fe2(SO4)3的CuSO4溶液中加入过量的CuO,过滤,取少量滤液,滴加KSCN溶液 | 不变红色 | 用这种方法可以得到纯净硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津静海一中等六校高一上期中化学卷(解析版) 题型:选择题
关于氧化还原反应,下列说法正确的是( )
①氧化剂发生氧化反应
②氧化剂具有氧化性
③某元素在反应中由化合物转化为单质,该元素一定被氧化
④物质所含元素化合价变化是判断氧化还原反应的依据
⑤失电子越多的还原剂,其还原性越强
A.①②④ B.②③④ C.②④ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上期中化学卷(解析版) 题型:选择题
X、Y、Z、W有如图所示的转化关系,则X、Y可能是
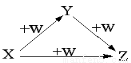
①C、CO
②AlCl3、Al(OH)3
③Na、Na2O
④NaOH、Na2CO3
A.①②③ B.①②
C.③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上期中化学卷(解析版) 题型:选择题
下列叙述正确的是
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.某元素从化合态变成游离态,该元素一定被还原
C.由同种分子构成的物质一定是纯净物
D.电离时能生成H+的化合物一定是酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西大学附中高二上期中化学卷(解析版) 题型:实验题
有同学探究了三价铁离子在水溶液中的一些反应:
I、甲组同学将氯化铁溶液滴加到碘化钾溶液中,发 现溶液的颜色变为浅绿色,请写出此反应的离子方程式 。同学们经过测定、查阅资料得出了以下结论:正向反应速率和I-、Fe3+的浓度关系为υ=k[I-]m[Fe3+]n(k为常数)
现溶液的颜色变为浅绿色,请写出此反应的离子方程式 。同学们经过测定、查阅资料得出了以下结论:正向反应速率和I-、Fe3+的浓度关系为υ=k[I-]m[Fe3+]n(k为常数)
[I-](mol·L-1) | [Fe3+ ]( mol·L-1) | υmol·L-1·s-1) | |
(1) | 0.20 | 0.80 | 0.032k |
(2) | 0.60 | 0.40 | 0.144k |
(3) | 0.80 | 0.20 | 0.128k |
通过所给数据计算得知:
(1)在υ=k[I-]m[Fe3+]n中,m、n的值为m=_________,n=_______ __。
__。
(2)碘离子浓度对反应速率的影响___________铁离子浓度对反应速率的影响。(选填:小于、大于、等于)。
II、乙组同学将硫氰化钾溶液滴入至氯化铁溶液中,得到了红色液体。
(1)在溶液中加入硫氰化钾粉末少量,颜色将 (填“变深”、“变浅”、“无明显现象”)。
(2)在溶液中加入氯化钾粉末少量,颜色将 (填“变深”、“变浅”、“无明显现象”)。
请用离子方程式解释原因: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西大学附中高二上期中化学卷(解析版) 题型:选择题
能说明醋酸是弱电解质的事实是( )
A.醋酸溶液的导电性比盐酸弱
B.醋酸溶液与碳酸钙反应,缓慢放出二氧化碳
C.醋酸溶液用水稀释后,氢离子浓度下降
D.0.1mol/L的CH3COOH溶液中,氢离子浓度约为0.001mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西大学附中高二上期中化学卷(解析版) 题型:选择题
下列关于化学平衡的说法中正确的是( )
A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,正反应速率和逆反应速率相等都等于0
C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变
D.化学平衡不可以通过改变条件而改变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上月考二化学卷(解析版) 题型:填空题
Ⅰ.在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
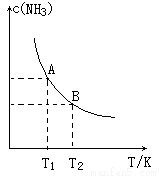
(1)当温度由T1变化到T2时,平衡常数关系K1___________K2(填“>”,“<”或“=”),焓变△H___________0.(填“>”或“<”)
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为___________,N2的转化率___________;
(3)T1温度下该反应的化学平衡常数K1=___________;
(4)T1温度时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L在这种情况下,该反应是否处于平衡状态___________(填是或否),此时反应速率是v正___________v逆(填>,<,=);
Ⅱ.根据最新 研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)。
研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)。
(1)此反应的△S 0(填“>”或“<”)。
已知2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-a kJ·mol-1
2NO(g)+O2(g)=2NO2(g) △H =-b kJ·mol-1;CO的燃烧热△H =-c kJ·mol-1。
(2)写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com