
【题目】(1)能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

该条件下反应的平衡常数为_____;若铁粉足量,CO2的起始浓度为2.0mol·L-1,则平衡时CO的浓度为____mol·L-1。
②下列措施中能使平衡时![]() 增大的是___(填字母)。
增大的是___(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
【答案】BC 2.0 1.33 A
【解析】
(1)紧扣化学平衡的特征进行判断,一是正、逆反应速率相等,一是变量不变;
(2)①先利用平衡常数的本义式求算出平衡常数,再利用三段式和平衡常数进行计算;
②在化学方程式确定后,平衡常数只是温度的函数;
(1)A.该反应是一个气体分子总数前后不变的反应,所以在恒温恒容条件下,压强始终不变,A项排除;
B.浓度不变是化学平衡建立的一个重要特征,B项可选;
C.v正(H2)代表氢气的消耗速率,v逆(H2O)代表了水的消耗速率(从反应式可以看出,与氢气的生成速率相等),所以此等式的成立代表了氢气的生成速率与消耗速率相等,反应达平衡,C项可选;
D.平衡时是浓度不变,不是相等,也不是成比例,所以D项排除;
所以答案选择BC项。
(2)①据图分析平衡时二氧化碳的浓度分别为0.5mol/L,二氧化碳的浓度变化为:1.5mol/L-0.5mol/L=1mol/L,根据反应方程式可以知道反应生成CO的浓度为1mol/L,则该反应的平衡常数K=![]() =
=![]() =2.0;
=2.0;
若CO2起始时的浓度为2.0mol/L,据反应方程式可以知道,反应消耗的二氧化碳的浓度与生成CO的浓度相等,设二者的浓度为xmol/L,则平衡时二氧化碳的浓度为(2.0-x)mol/L,
K=![]() =2.0,解得x=
=2.0,解得x=![]() ,所以平衡时CO的浓度为1.33mol/L、二氧化碳的浓度为(2.0-
,所以平衡时CO的浓度为1.33mol/L、二氧化碳的浓度为(2.0- ![]() )mol/L= x=
)mol/L= x=![]() mol/L;
mol/L;
②所给比例式即为该反应的平衡常数,而平衡常数只随温度变化而变化,不随浓度、压强等变化。该反应是正向吸热的反应,温度升高,平衡常数将增大。
A.升高温度,平衡正向进行,平衡常数增大,A项正确;
B.增大压强,平衡不动,平衡常数也不变,B项错误;
C.充入一定量的二氧化碳,平衡正向移动,但因为温度不变,平衡常数不变,C项错误;
D.铁粉为固体,再加入铁粉,平衡不发生移动,该反应的平衡常数不变,D项错误;
所以答案选择A项。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是![]()
A.“酸雨”、“臭氧层受损”、“光化学烟雾”都与氮氧化物有关
B.PM2.5作为空气质量预报的一项重要指标,它是指空气中直径小于或等于2.5m的颗粒物,该值越高,代表空气污染程度越严重
C.静电除尘治理悬浮颗粒污染,其依据是胶体的电泳原理
D.为消除碘缺乏症,卫生部规定食盐中必须加含碘物质,食盐中所加含碘物质是KI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净干燥的氯气与熔融金属锡反应可制备SnCl4,某化学小组的同学设计了如下实验装置进行制备。
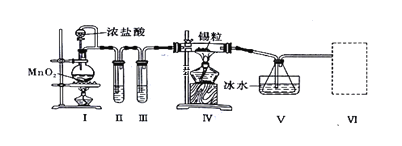
已知:①金属锡熔点为231℃,化学活泼性与铁相似;②SnCl4的沸点为114℃;③SnCl4易与水反应。
请根据上图装置回答:
(1)装置I中反应的离子方程式是________________________________________
(2)试管II中的试剂是________,试管III中的试剂是____________。
(3)装置V的作用是____________。
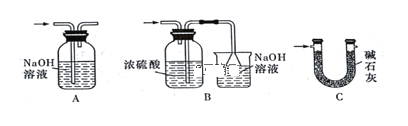
(4)裝置Ⅵ 最好选用下列装置中的________(填标号)。
(5)实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g) ΔH=-Q kJ·mol1(Q>0)。在温度为T1时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,经过4 min反应达到平衡,平衡时H2O(g)的物质的量分数为2%,则下列说法不正确的是
COS(g)+H2O(g) ΔH=-Q kJ·mol1(Q>0)。在温度为T1时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,经过4 min反应达到平衡,平衡时H2O(g)的物质的量分数为2%,则下列说法不正确的是
A.CO2的平衡转化率α=2.5%
B.0~4 min内用H2S表示该反应的速率为0.001 mol·L1·min1
C.上述条件下反应达到平衡时放出的热量为0.01Q kJ
D.其他条件不变,若该反应在温度为T2条件下进行,达到平衡所需时间小于4 min,则T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25° C时,二元酸H2X的电离平衡常数K1=5.0×10-2,K2=5.4×10-5。此温度下用AgNO3溶液分别滴定浓度均为0.01mol·L-1的KY和K2X溶液,所得的沉淀(AgY和Ag2X)溶解平衡图像如图所示。下列叙述正确的是
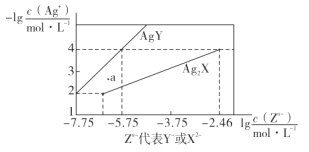
A.25°C时,KHX的溶液pH>7
B.反应Ag2X+2Y- 2AgY+ X2-的平衡常数为103.29
C.a点既可以表示AgY的不饱和溶液也可以表示Ag2X的过饱和溶液
D.向c(Y-)=c(X2-)=0.01 mol·L-1的混合液中滴入AgNO3溶液时,先生成AgY沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸(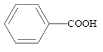 )广泛应用于制药和化工行业。某小组同学尝试利用甲苯(
)广泛应用于制药和化工行业。某小组同学尝试利用甲苯(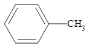 )的氧化反应制备苯甲酸,反应原理为:
)的氧化反应制备苯甲酸,反应原理为:
 +2KMnO4
+2KMnO4![]()
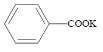 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
 +HCl
+HCl![]()
 +KCl
+KCl
相关物质的部分信息如下表:
名称 | 相对分子质量 | 性状 | 熔点/℃ | 沸点/℃ | 密度 /gmL-1 | 溶解度 | |
4℃冷水 | 75℃热水 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.87 | 不溶 | 不溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.27 | 0.18 | 2.20 |
实验装置(部分夹持装置已略去)和流程如下:
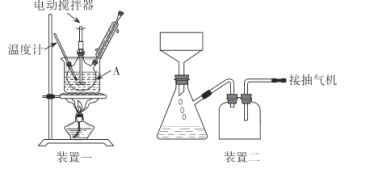
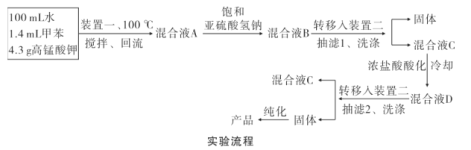
请回答:
(1)装置一中A的名称为___,在本实验中,下列规格的A中最合适的是___(填字母)。
A.50 mL B.100mL C.150 mL D.250 mL
(2)相对于用酒精灯直接加热,用热水浴加热的优点是_____。
(3)判断甲苯被氧化完全的实验现象是_____。
(4)抽滤可利用装置二完成,抽滤的优点是____。抽滤1后洗涤固体应选___(填序号,下同),抽滤2后洗涤固体应选_____。
A.4 °C冷水 B.75 °C热水 C.A和B均可
(5)混合液A中加入适量饱和亚硫酸氢钠溶液的目的是_____,若不加入,产生的主要问题是____。
(6)纯化固体时可采用的物理方法的名称是___。
(7)若加入1.4 mL甲苯,纯化后所得产品的质量为1.0 g,则苯甲酸的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用光能分解水的装置如图,在直流电场作用下,双极性膜将水解离为H+和OH,并实现其定向通过。下列说法错误的是( )
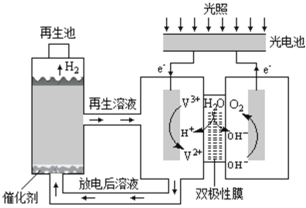
A.光电池能将光能转化为电能
B.阳极区发生的电极反应为:2H2O4e=4H++O2↑
C.双极性膜能控制两侧溶液的酸碱性不同
D.再生池中发生的反应为:2V2++2H+=2V3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿比朵尔是一种抗病毒药物,其分子结构如图,关于阿比朵尔说法不正确的是
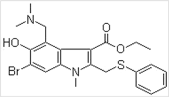
A.阿比朵尔分子式为 C22H24BrN2O3S
B.阿比朵尔能与碱或酸溶液反应生成盐
C.阿比朵尔一定条件下能发生取代、加成、氧化、还原反应
D.一定条件下,1 mol 阿比朵尔与足量 NaOH 溶液反应,最多可消耗 4 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸法钛白粉生产中排放的含锰废水(主要金属离子为Mn2+、Fe2+、Al3+,还含有少量Ca2+、Mg2+、Cu2+和Ni2+等离子)为原料,生产MnCO3的工艺流程如下:
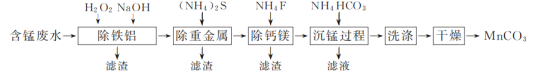
已知:25 ℃时,Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11。
(1)流程中含锰废水经过前三步预处理,得到主要含有Mn2+的母液。
①除铁铝时,在搅拌条件下先加入H2O2溶液,再加入NaOH溶液调节pH。加入H2O2溶液时发生反应的离子方程式为__________________________________________。
②除钙镁步骤中,当Ca2+、Mg2+沉淀完全时,溶液中![]() =________。
=________。
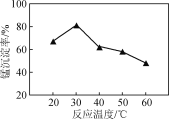
(2) 沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。
①沉锰过程发生反应的离子方程式为____________。该过程中加入适当过量的NH4HCO3的原因是________。
②当温度超过30 ℃,沉锰反应的锰沉淀率随温度升高而下降的原因是______________________________。
(3) 沉锰后过滤得到MnCO3粗产品,依次用去离子水和无水乙醇各洗涤2~3次,再低温干燥,得到纯净的MnCO3。用无水乙醇洗涤的目的是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com