
 某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
| c(碱)?V(碱) |
| V(酸) |
 CH3COO--+H+、H2O
CH3COO--+H+、H2O OHˉ+H+,
OHˉ+H+, CH3COO--+H+、H2O
CH3COO--+H+、H2O OHˉ+H+;
OHˉ+H+; | c(碱)?V(碱) |
| V(酸) |
| ||
| VmL |
| ||
| VmL |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
| A、室温下,该溶液的pH=7 |
| B、适当加热该溶液,溶液的PH值升高 |
| C、c(Na+)>c(A-)>c(H+)>c(OH-) |
| D、c(Na+)+c(H+)=c(A-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
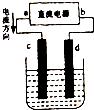 图是电解CuCl2溶液的装置,其中c、d为石墨电极.
图是电解CuCl2溶液的装置,其中c、d为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知25℃、101kPa下,氢气、甲烷和葡萄糖C6H12O6(S)的燃烧热依次为285.8kJ/mol、890.3kJ/mol、2800kJ/mol.
已知25℃、101kPa下,氢气、甲烷和葡萄糖C6H12O6(S)的燃烧热依次为285.8kJ/mol、890.3kJ/mol、2800kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,饱和AgCN溶液与饱和AgCl溶液相比,前者的c(Ag+)大 |
| B、25℃时,向AgCl的悬浊液中加入少量NaCN固体,c(Cl-)增大 |
| C、25℃时,AgCN固体在20mL 0.01mol?L-1 NaCN溶液中的Ksp比在20mL 0.01mol?L-1 HCN(弱酸)溶液中的Ksp小 |
| D、25℃时,向AgCl的饱和溶液中加入足量浓AgNO3溶液,溶液中各离子浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、AlO2-、CO32- |
| B、Na+、Cl-、SiO32-、K+ |
| C、Na+、NO3-、AlO2-、K+ |
| D、Na+、Cl-、HCO3-、Ba2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com