
【题目】NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
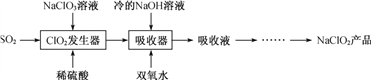
(1) ClO2发生器中发生反应的离子方程式为_________________。
(2) 吸收器中反应温度不能高于5 ℃的可能原因有____________。
(3) 查阅资料可知:
Ⅰ.ClO2能被I-还原为ClO2-或Cl-:
2ClO2+2I-![]() 2ClO2-+I2
2ClO2-+I2
2ClO2+8H++10I-![]() 2Cl-+5I2+4H2O
2Cl-+5I2+4H2O
ClO2的转化率与溶液pH的关系如图所示。

Ⅱ.pH≤2.0时,ClO2-能被I-完全还原为Cl-:ClO2-+4H++4I-![]() Cl-+2I2+2H2O
Cl-+2I2+2H2O
取少量吸收液加水稀释至一定体积后得溶液Y,可通过下列步骤测定溶液Y中ClO2、ClO2-的浓度:
步骤1:准确量取25.00 mL溶液Y,调节溶液的pH为8.0,加入足量的KI晶体。滴入2滴淀粉溶液,滴加0.020 00 mol·L-1 Na2S2O3溶液,发生反应:2Na2S2O3+I2![]() Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
步骤2:调节上述反应后溶液的pH为1.0,滴加0.250 0 mol·L-1 Na2S2O3溶液。恰好完全反应时,消耗0.250 0 mol·L-1 Na2S2O3溶液40.00 mL。
①判断Na2S2O3溶液与I2恰好完全反应时的实验现象是____________。
②请计算溶液Y中ClO2-的物质的量浓度_____________(写出计算过程)。
【答案】 2SO2+ClO3-=C1O2+2SO42- 防止过氧化氢分解、提高ClO2的吸收率 蓝色褪去 0.09 mol·L-1
【解析】(1)由流程图可知C1O2发生器中目的是产生C1O2,二氧化硫具有还原性,将ClO3-还原为C1O2,自身被氧化为SO42-,反应离子方程式为2SO2+ClO3-=C1O2+2SO42-;(2)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能超过5℃,其目的是防止过氧化氢分解、提高ClO2的吸收率;(3) ①原溶液中生成了碘单质,加入淀粉后溶液变成蓝色,当反应结束时碘单质消失,溶液变成无色,所以滴定终点的现象为:溶液的蓝色恰好褪去,且半分钟内不恢复;②根据反应:2ClO2+2I-![]() 2ClO2-+I2、ClO2-+4H++4I-
2ClO2-+I2、ClO2-+4H++4I-![]() Cl-+2I2+2H2O、2Na2S2O3+I2
Cl-+2I2+2H2O、2Na2S2O3+I2![]() Na2S4O6+2NaI,设25.00 mLY中含有xmol C1O2、ymol ClO2-,则
Na2S4O6+2NaI,设25.00 mLY中含有xmol C1O2、ymol ClO2-,则
步骤1、2ClO2----I2-----2Na2S2O3
2 2
x ![]()
步骤2、ClO2-----2I2-----4Na2S2O3
1 4
y ![]()
x= ![]()
x+y= ![]()
y= ![]() ,c(ClO2-)=
,c(ClO2-)=![]() =0.09mol/L。
=0.09mol/L。


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、NH、I—、CO![]()
B. 0.1 mol·L-1 KNO3溶液中:Na+、Fe2+、Cl—、SO![]()
C. 使甲基橙变红的溶液中:Na+、Mg2+、SO![]() 、AlO
、AlO
D. 水电离产生的c(H+) =10-13mol·L-1的溶液中:K+、Ca2+、NO、HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol·L1的硫酸,其他试剂任选.填写下列空白.
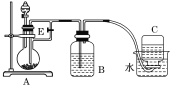
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是________________________________________。
(2)实验开始时就先将活塞E________(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程________________________________________。
(4)拔去装置B中的橡皮塞,使空气进入,装置B中发生的现象为 ______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是
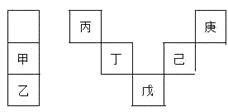
A. 丙与戊的原子序数相差28
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质均能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法不正确的是( )
A. 除去乙酸乙酯中混有的乙酸,可以用饱和碳酸钠溶液
B. 顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同
C. 聚合物![]() 可由单体CH3CH=CH2和CH2=CH2加聚制得
可由单体CH3CH=CH2和CH2=CH2加聚制得
D. C3H2Cl6有4种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)化合物F(![]() )是重要的化工原料,其一种合成路线如下:
)是重要的化工原料,其一种合成路线如下:

已知

(1)写出B的官能团名称___________。
(2)下列有关物质C的说法正确的是________。
A.C的分子式是C9H12O3 B.C的核磁共振氢谱共有4组吸收峰
C.1mlC最多消耗1mol金属Na D.C可以发生取代、加成和消去反应
(3)写出①的化学方程式:____________________________________。
(4)E的结构简式为________________________________________________。
(5) 有多种同分异构体,能发生银镜反应的芳香族化合物有____________种,其中满足下列条件的同分异构体的结构简式为____________
有多种同分异构体,能发生银镜反应的芳香族化合物有____________种,其中满足下列条件的同分异构体的结构简式为____________
①1mol该物质最多消耗3 mol NaOH; ②苯环上一氯代物只有两种。
(6)参照上述合成路线,设计由乙烯合成2-丁醇的合成路线。(用合成路线流程图表示,并注明反应条件,合过程中只有无机试剂可任选) ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化磷(PCl3)是一种用于有机合成的重要催化剂。已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解。PCl3、POCl3的熔沸点见下表。
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请答下面问题:
(1)选下图所示发生装置,可分别制备氯气

你选用的装置是___________,反应的离子方程式为____________
(2)实验室常用下图所示装置制取PCl3。

①玻璃管之间的连接需要用到胶皮管,连接的方法是:先把_______,然后稍稍用力即可把玻璃管插入橡皮管。
②B中所盛试剂是____________________,F中碱石灰的作用是_____________________。
③实验时,检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是______________________________,C装置中的K1、 K2的设计也出于类似的目的,为了达到这—实验目的,实验时与K1、 K2有关的操作是___________________。
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5,加入红磷时发生反应的化学方程式为_________________________,然后通过__________________(填实验操作名称),即可得到较纯净的PCl3。
(4) 通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000 mol/L Na2S2O3溶液8.00mL.
己知:H3PO3+I2+H2O=H3PO4+2HI, I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工模拟光合作用,设计的电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是

A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从a极向b极迁移
C. 该转化过程中,水得到电子
D. 该装置中发生的总反应为6CO2+8H2O![]() 2C3H8O+9O2
2C3H8O+9O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com