解答:
解:(1)①工业上一般可采用如下反应来合成甲醇:CO(g)+2H
2(g)?CH
3OH(g)△H═-86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入Imol CO和2mol H
2,反应达到平衡时,容器内的压强是开始时的
,依据化学平衡三段式列式,设消耗的一氧化碳物质的量为x;
CO(g)+2H
2(g)?CH
3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol)1-x 2-2x x
1-x+2-2x+x=3×
x=0.6,
一氧化碳转化率=60%,
故答案为:60%;
②CO(g)+2H
2(g)?CH
3OH(g)△H═-86.6KJ/mol,反应是气体体积减小的放热反应;
A.反应速率之比等于化学方程式系数之比,是正反应之比,v(H
2)正═2v(CH
3OH)逆,才能说明反应达到平衡状态,故A错误;
B.CO的消耗速率等于CH
3OH的生成速率,说明费用正向进行,不能说明反应达到平衡状态,故B错误;
C.反应前后气体物质的量改变,容器内的压强保持不变,气体物质的量不变,说明反应达到平衡状态,故C正确;
D.气体质量不变,体积固定,混合气体的密度保持不变,不能说明反应达到平衡状态,故D错误;
E.混合气体都是无色气体,颜色保持不变不能说明反应达到平衡状态,故E错误;
F.气体质量不变,物质的量变化,混合气体的平均相对分子质量不随时间而变化,说明反应达到平衡状态,故F正确;
故答案为:CF;
(2)①2CH
3OH(l)+3O
2(g)═2CO
2(g)+4H
2O(g)△H═-akJ?mol
-1②2CO(g)+O
2(g)═2CO
2(g)△H═-bkJ?mol
-1③H
2O(g)═H
2O(l)△H═-ckJ?mol
-1依据盖斯定律计算,
得到热化学方程式:CH
3OH(l)+O
2(g)═CO(g)+2H
2O(l)△H═
KJ/mol;
故答案为:
;
(3)①燃料电池,电池的一个电极通 入空气,另一个电极通入甲醇气体,电解质是氢氧化钠溶液,根据原电池原理,正极电极反应是O
2得到电子生成氢氧根离子
-:O
2+2H
2O+4e
-=4OH
-,负极电极反应:CH
3OH-6e
-+8OH
-=CO
32-+6H
2O;
故答案为:CH
3OH-6e
-+8OH
-=CO
32-+6H
2O;
②燃料电池,电池的一个电极通 入空气,另一个电极通入甲醇气体,电解质是氢氧化钠溶液,根据原电池原理,正极电极反应是O
2得到电子生成氢氧根离子
-:O
2+2H
2O+4e
-=4OH
-,负极电极反应:CH
3OH-6e
-+8OH
-=CO
32-+6H
2O;电解一段时间后,当两极收集到相同体积(相词条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),200ml溶液中含有c(Cu
2+)=0.5mol/L,c(H
+)=2mol/L,c(Cl
-)=2mol/L,c(SO
42-)=0.5mol/L;
阳极氯气和阴极氢气相同,设阳极生成的氧气物质的量为x,阴极上也应生成氢气物质的量x
阳极电极反应为:2Cl
--2e
-=Cl
2↑,4OH
--4e-=2H
2O+O
2↑,
0.4mol 0.4mol 0.2mol 4x x
阴极电极反应为:Cu
2++2e
-=Cu,
0.1mol 0.2mol 0.1mol
2H
++2e
-=H
2↑; 2H
++2e
-=H
2↑;
0.4mol 0.4mol 0.2mol 2x x
依据电子守恒0.4+4x=0.2+0.4+2x,
x=0.1mol,
阳极上收集到氧气的物质的量0.1mol,质量为3.2g,
故答案为:3.2g;



 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
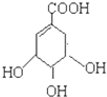
 ),其反应是
),其反应是