
如图所示,甲池的总反应式为N2H4+O2=N2+2H2O,.下列说法正确的是()
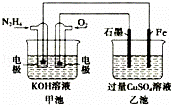
A. 甲池中负极上的电极反应式为N2H4﹣4e﹣=N2+4H+
B. 乙池中石墨电极上发生的反应为4OH﹣﹣4e﹣=2H2O+O2↑
C. 甲池溶液pH增大,乙池溶液pH减小
D. 甲池中每消耗0.1mol N2H4乙池电极上则会析出6.4g固体
考点: 原电池和电解池的工作原理.
分析: A、甲池中为原电池反应,N2H4失电子生成氮气;
B、乙池中为电解反应,石墨电极与正极相连为阳极,氢氧根在阳极失电子发生氧化反应;
C、根据电池的总反应判断PH的变化;
D、根据电路中每个电极得失电子守恒计算.
解答: 解:A、甲池中为原电池反应,负极N2H4﹣4e﹣+4OH﹣=N2+4H2O,故A错误;
B、乙池中为电解反应,石墨电极与正极相连为阳极,氢氧根在阳极失电子发生氧化反应,反应式为4OH﹣﹣4e﹣=2H2O+O2↑,故B正确;
C、甲池中因反应生成了水会使溶液的pH值减小,乙池中因反应生成了酸也会使溶液的pH值减小,故C错误;
D、甲池中每消耗0.1mol N2H4,则根据负极N2H4﹣4e﹣+4OH﹣=N2+4H2O,转移0.4mol电子,所以乙池电极上则会析出 ×64g/mol=12.8g铜,故D错误.
×64g/mol=12.8g铜,故D错误.
故选B.
点评: 本题考查了原电池、电解池工作的基本原理,以及原电池电极反应式的书写,题目难度中等,注意把握原电池和电解池中电极方程式的书写方法.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
用NA表示阿伏德罗常数,下列叙述正确的是()
A. 标准状况下,22.4LH2O含有的分子数为 NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C. 通常状况下,NA 个CO2分子占有的体积为22.4L
D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣ 个数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语正确的是()
A. F结构示意图为: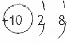
B. HCl的电子式为:H+
C. Na2O2的形成过程可以表示为: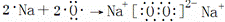
D. 次氯酸(HClO)的结构式为:H﹣Cl﹣O
查看答案和解析>>
科目:高中化学 来源: 题型:
银制器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故.根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去.下列说法正确的是()
A. 处理过程中银器一直保持恒重
B. 银器为正极,Ag2S被还原生成单质银
C. 该过程中总反应为2Al+3Ag2S═6Ag+Al2S3
D. 黑色褪去的原因是黑色Ag2S转化为白色AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醛在酸性催化剂存在下三分子聚合可以生成性质相对稳定、毒性小、易于运输的三聚甲醛,反应如图所示.下列说法正确的是()

A. 甲醛水溶液可作为食物防腐剂
B. 该反应类型为缩聚反应
C. 三聚甲醛分子中既含σ键又含п键
D. 常温下,9g三聚甲醛中含1.806×1023个碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
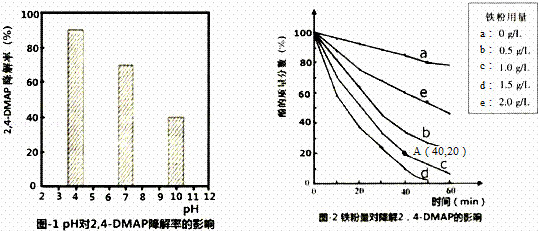
利用Na2S2O8产生的强氧化性SO4﹣•(自由基)降解有机污染物是目前最具潜力的高级氧化技术.文献报道某课题组探究pH,单质铁和Na2S2O8的浓度对降解2,4﹣DMAP(2,4﹣﹣甲基苯酚)效率的影响.
(1)探究溶液酸碱性的影响:将等量的2,4﹣DMAP加入到不同pH的Na2S2O8溶液中,结果如图1所示.由此可知:溶液酸性增强, (填“有利于”或“不利于”)Na2S2O8产生SO4﹣•.
(2)探究铁粉用量的影响:
①实验前,先用0.1mol•L﹣1 H2SO4洗涤Fe粉,其目的是 ,后用蒸馏水洗涤至中性;
②相同条件下,取不同量处理后的铁粉分别加入c(2,4﹣DMAP)=1.0×10 ﹣3mol•L﹣1、c(Na2S2O8)=4.2×10﹣3mol•L﹣1的混合溶液中,实验结果如图2所示.其中降解效率最好的铁粉用量是1.5g/L;计算从反应开始到A点时,2,4﹣DMAP降解的平均反应速率为 (忽略反应过程中溶液总质量变化).
③已知:2Fe+O2+2H2O=2Fe2++4OH﹣,S2O8﹣+Fe2+=SO4﹣+SO42﹣+Fe3+此外还可能会发生:SO4﹣+Fe2+=SO42﹣+Fe3+.当铁粉加入量过大时,2,4﹣DMAP的降解率反而下降,原因可能是(用离子方程式表示). .
(3)探究Na2S2O8浓度的影响:填写下表中空格,完成实验方案.
序号、物理量 M(Fe粉)/g V/mL V/mL 收集数据和得出结论
1 100 0.3 50 50
2 100V(污水)/mL 0.3
查看答案和解析>>
科目:高中化学 来源: 题型:
2HI(g)⇌H2(g)+I2(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是()
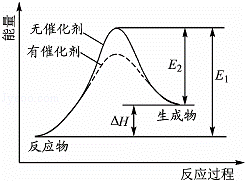
A. 升高温度,反应速率增大,△H减小
B. 升高温度,不影响活化分子百分数
C. 催化剂能降低该反应的活化能
D. 逆反应的活化能等于正反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
固体NH4Br置于密闭容器中,某温度下发生反应:NH4Br(s)⇌NH3(g)+HBr(g),2HBr(g)⇌Br2(g)+H2(g),2min后测知H2的浓度为0.5mol•L﹣1,HBr的浓度为4mol•L﹣1,若上述反应速率用v(NH3)表示,则下列速率正确的是()
A. 0.5mol•L﹣1•min﹣1 B. 2.5mol•L﹣1•min﹣1
C. 2mol•L﹣1•min﹣1 D. 1.25mol•L﹣1•min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 凡是放热反应都是自发的,由于吸热反应都是非自发的
B. 自发反应一定是熵增大,非自发反应一定是熵减少或不变
C. 自发反应在恰当条件下才能实现
D. 自发反应在任何条件下都能实现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com