
| A. | 食醋 | B. | 白酒 | C. | 食盐 | D. | 葡萄糖 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 用于合成氨的工业煤气中含有H2S、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理.
用于合成氨的工业煤气中含有H2S、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
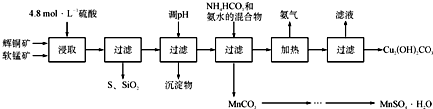
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn 2+ | 8.3 | 9.8 |
| Cu 2+ | 4.4 | 6.4 |
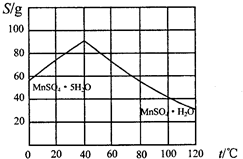
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 选用的仪器 | |||||
| 添加的药品(或必要的操作) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将适量的发酵粉放在容器中加热,观察气体的产生 | |
| B. | 在洁净的水杯中先加入小苏打粉,再加入食醋,观察气体 | |
| C. | 往稀白粥中加入少量加碘食盐,检验加碘食盐中含有I2 | |
| D. | 在一瓣橘子上插入两根铜丝并与小灯泡连接,验证电流的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 目 的 | 化学试剂及方法 | 供选择的化学试剂及方法 A.加入硝酸酸化的硝酸银溶液 B.加入食醋,加热 C.灼烧、闻气味 D.加入新制氢氧化铜悬浊液,加热 E.将样品滴在淀粉碘化钾试纸上 |
| 除去热水瓶中的水垢 | ||
| 鉴别蔗糖和葡萄糖 | ||
| 验证味精中是否含有食盐 | ||
| 区别毛织物和棉织物 | ||
| 检验自来水是否含Cl2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g O2 | B. | 0.3mol NaCl | ||
| C. | 标准状况下4.48L CH4 | D. | 含有3.01×1022个氧原子的H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 漂白粉的成分为次氯酸钙 | |
| D. | SO2可用于漂白食品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com