
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
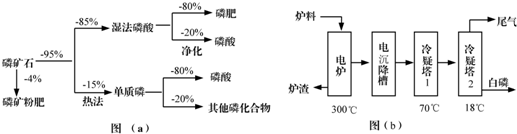
分析 (1)由图(a)可知生产含磷肥料,约占磷矿石使用量的比例为:4%+96%×85%×80%=69%;
(2)以磷矿石为原料,用过量的硫酸溶解Ca5F(PO4)3可制得磷酸,根据质量守恒书写化学方程式;根据P元素守恒可得关系式P2O5~2H3PO4,依据此关系式计算;
(3)将SiO2、过量焦炭与磷灰石混合,高温除了反应生成白磷之外,得到的难溶性固体是CaSiO3;根据冷却塔1、2的温度与白磷的熔点比较分析白磷的状态;
(4)二氧化硅和HF反应生成四氟化硅气体,过量的焦炭不完全燃烧生成CO,因此在尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等;将尾气通入纯碱溶液,SiF4、HF、H2S与碳酸钠反应而除去,次氯酸具有强氧化性,可除掉强还原性的PH3;
(5)相比于湿法磷酸,热法磷酸工艺所得产品纯度大;
解答 解:(1)由图(a)可知生产含磷肥料,约占磷矿石使用量的比例为:4%+96%×85%×80%=69%,
故答案为:69;
(2)以磷矿石为原料,用过量的硫酸溶解Ca5F(PO4)3可制得磷酸,根据质量守恒定律可得反应的化学方程式为Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑;
根据P元素守恒可得关系式P2O5~2H3PO4,142份P2O5可制取196份磷酸,1t折合含有P2O5约30%的磷灰石,含有P2O5的质量为0.3t,所以可制得到85%的商品磷酸的质量为$\frac{196×0.3t}{142×85%}$=0.49t,
故答案为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑;0.49;
(3)将SiO2、过量焦炭与磷灰石混合,高温除了反应生成白磷之外,得到的难溶性固体是CaSiO3;冷却塔1的温度是70℃,280.5℃>t>44℃,所以此时主要的沉积物是液态白磷;冷却塔2的温度是18℃,低于白磷的熔点,故此时的主要沉积物是固体白磷,
故答案为:CaSiO3;液态白磷;固态白磷;
(4)二氧化硅和HF反应生成四氟化硅气体,过量的焦炭不完全燃烧生成CO,因此在尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等;将尾气通入纯碱溶液,SiF4、HF、H2S与碳酸钠反应而除去,次氯酸具有强氧化性,可除掉强还原性的PH3,
故答案为:SiF4、CO;SiF4、H2S、HF;PH3;
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但是所得产品纯度大,杂质少,因此逐渐被采用,
故答案为:产品纯度高.
点评 本题考查了化工生产流程图,涉及磷矿石的主要用途、反应原理和有关计算,该题是高考中的常见题型,题目难度中等,侧重对学生分析问题、解答问题能力的培养.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应是放热反应还是吸热反应,由生成物与反应物的焓值差决定 | |
| B. | 升高温度,可以改变化学反应的反应热 | |
| C. | △H的大小与热化学方程式中的化学计量数无关 | |
| D. | 1 mol H2在足量Cl2中完全燃烧所放出的热量,是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 一个化学反应的△H与实际参加化学反应的物质的多少无关,而与热化学方程式的计量系数有关 | |
| C. | 中和热测定实验中,将碱溶液分多次缓慢加入酸溶液中可减小实验误差 | |
| D. | 在海轮外壳连接锌块保护外壳不受腐蚀采用的是牺牲阳极的阴极保护法,属于电解原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(石墨,s)═C(金刚石,s)△H=+11.9 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 已知在稀溶液中:H+(aq)+OH-(aq)═H2O(l);△H=-57.3 kJ/mol.若将含0.5mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ | |
| D. | 甲烷的标准燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2 O2(g)═CO2(g)+2H2O (g)△H=-890.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙苯催化脱氢制苯乙烯反应如图1:
乙苯催化脱氢制苯乙烯反应如图1:| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | X | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、KOH、CaO | B. | CO、NaOH、KCl | ||
| C. | H2O、H2SO4、NaCl | D. | CuO、Cu2(OH)2CO3、CaCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com