
 原硅酸的结构如图,若去掉氢原子后的剩余部分即SiO44-为原硅酸,其构型为正四面体,四面体顶角上的氧原子叫“角氧”.有关叙述正确的是( )
原硅酸的结构如图,若去掉氢原子后的剩余部分即SiO44-为原硅酸,其构型为正四面体,四面体顶角上的氧原子叫“角氧”.有关叙述正确的是( )| A. | 两分子原硅酸脱去一分子水得到的H6Si2O7分子中有6个Si-O键 | |
| B. | 两个硅氧四面体,彼此用一个角氧相连后,形成的Si2O76-离子中各键角均为109°28′ | |
| C. | 3个硅氧四面体彼此用3个角氧相连后,形成的Si3O96-离子呈链状 | |
| D. | n个硅氧四面体彼此用四个角氧连接后的晶体是二氧化硅 |
分析 A.两分子原硅酸脱去一分子水得到的H6Si2O7分子Si-O键数目不变;
B.两个硅氧四面体,彼此用一个角氧相连后,形成的Si2O76-离子后,有一个角氧形成的化学键发生变化;
C.3个硅氧四面体彼此用2个角氧相连;
D.根据组成元素和空间结构分析.
解答 解:A.两分子原硅酸脱去一分子水得到的H6Si2O7分子,该分子的结构为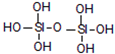 ,Si-O键数目不变,含有8个Si-O键,故A错误;
,Si-O键数目不变,含有8个Si-O键,故A错误;
B.两个硅氧四面体,彼此用一个角氧相连后,形成的Si2O76-离子后,有一个角氧形成的化学键发生变化,没有形成离子时每个O原子均连接一个H原子,形成离子后四个O中有一个O原子上没有H,则该角氧形成的化学键发生变化,所以分子的构型也发生变化,则不再是四面体结构,故B错误;
C.3个硅氧四面体彼此用2个角氧相连,故C错误;
D.n个硅氧四面体彼此用四个角氧连接后形成空间网状结构的晶体,是通过Si-O共价键结合形成是二氧化硅,故D正确.
故选D.
点评 本题考查了分子的结构、化学键、晶体等,题目难度不大,注意把握题中所给信息,侧重于考查学生对信息的应用能力.


科目:高中化学 来源: 题型:解答题
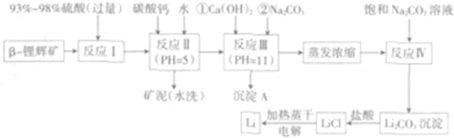
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液质量减轻 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+与Fe2+的物质的量比为1:1 | |
| D. | Fe位于元素周期表第四周期Ⅷ族,是一种过渡金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
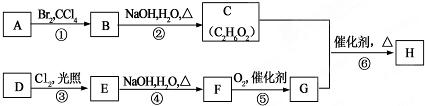
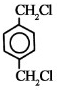 ;
;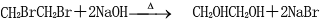 ⑥
⑥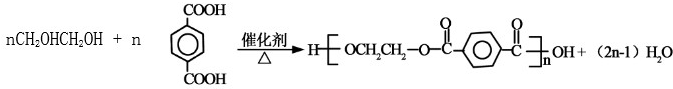 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
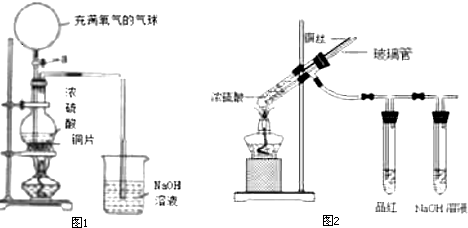
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{19}^{40}K$与${\;}_{20}^{40}Ca$ | B. | T2O与H2O | ||
| C. | ${\;}_{19}^{40}K$与${\;}_{19}^{39}K$ | D. | 金刚石与石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 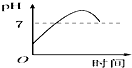 | B. | 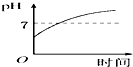 | C. |  | D. | 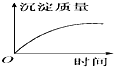 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②④⑤ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com