
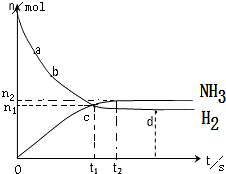
 合成氨工业对国民经济和社会发展具有重要的意义.一定温度下,在2L的密闭容器中加入一定量的N2和H2,发生合成氨反应,其中n(NH3)和n(H2)随时间变化的关系如图所示.
合成氨工业对国民经济和社会发展具有重要的意义.一定温度下,在2L的密闭容器中加入一定量的N2和H2,发生合成氨反应,其中n(NH3)和n(H2)随时间变化的关系如图所示.| △c |
| △t |
| 3 |
| 2 |
| 3 |
| 4 |
| △c |
| △t |
| ||
| t2 |
| 3n2 |
| 4t2 |
| 3n2 |
| 4t2 |


科目:高中化学 来源: 题型:
| A、强电解质溶液的导电性不一定比弱电解质溶液的导电性强 |
| B、常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| C、若测得雨水的pH小于7,则下的是酸雨 |
| D、在通风橱中进行有毒气体实验符合“绿色化学”思想 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B、10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| C、10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) |
| D、10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、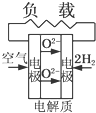 固体氧化物燃料电池 |
B、 碱性氢氧燃料电池 |
C、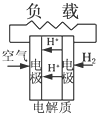 质子交换膜燃料电池 |
D、 熔融盐燃料电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2CH4(g)+
| ||
B、2CH4(g)+
| ||
| C、3CH4(g)+5O2(g)=CO2(g)+2CO(g)+6H2O(g);△H=-1840kJ?mol-1 | ||
| D、3CH4(g)+5O2(g)=CO2(g)+2CO(g)+6H2O(1);△H=-1538kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制FeCl3溶液时,应将FeCl3溶解在适量的盐酸中 |
| B、进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C、用CCl4萃取碘水中的I2时,有机层从分液漏斗的下端放出 |
| D、酸碱中和滴定时,锥形瓶需用待测液润洗2遍,再加入待测液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com