
【题目】基于新材料及3D打印技术,科学家研制出一种微胶囊吸收剂,它能将工厂排放的CO)以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充有Na2CO3溶液,其原理如图所示。

(1)这种微胶囊吸收CO2的原理是 ____用离子方程式表示),此过程是_____填“吸收”或“放出”)能量的过程。
(2)在吸收过程中下列关于胶囊内溶液的说法正确的是 ___(填字母)。
a.吸收前溶液中c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
b.吸收过程中,体系中的含碳微粒只有CO32-、HCO3-、H2CO3
c.当n(CO2):n(Na2CO3)=1:3时,溶液中c(CO32-)<c(HCO3-)
d.溶液中始终有c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
(3)将解吸后的CO2催化加氢可制取乙烯。
已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H1=-1323kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H2=-483.6kJ·mol-1
2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) △H3=_______________
(4)在体积为2L的恒容容器中发生反应:2CO2(g)+6H2(g)=C2H4(g)+4H2O(g)。当投料为1 mol CO2(g)和3molH2 (g)时,测得温度对CO2平衡转化率的影响为曲线a,改变投料比![]() 测量后得到曲线b。
测量后得到曲线b。
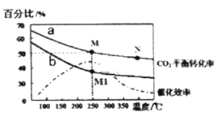
①根据曲线a计算250℃时该反应的化学平衡常数K= ____代入数值列出计算式即可)。
②b条件下投料比![]() ____(填“>” “<”或“=”)3,判断依据是 __ 。
____(填“>” “<”或“=”)3,判断依据是 __ 。
③下列说法正确的是 ___(填字母)。
A.平衡常数大小:M>N>M1
B.其他条件不变,b条件时增加催化剂用量,则250℃时CO2的平衡转化率可能达到M
C.当压强、混合气体的密度或![]() 不变时均可视为化学反应已达到平衡状态
不变时均可视为化学反应已达到平衡状态
D.工业生产中采取较高温度(250℃左右)是为了提高催化剂活性加快反应速率
【答案】CO2+CO32-+H2O=2HCO3- 放出 cd -127.8kJ·mol-1 ![]() < 其他条件不变时,减少氢气的浓度,可以减少CO2的转化率 D
< 其他条件不变时,减少氢气的浓度,可以减少CO2的转化率 D
【解析】
(1)根据CO2与CO32-反应进行分析,根据图像解吸是吸收过程;
(2)根据盐类水解,结合物料守恒和电荷守恒进行判断;
(3)利用盖斯定律进行分析和计算;
(4)①利用“三段式”方法进行分析计算;
②根据图像,b曲线CO2平衡转化率比曲线a低,其他条件不变,增大H2的量,CO2的转化率增大,据此分析;
③根据图像可以得到催化效率随温度变化进行分析;
(1)胶囊内部充有Na2CO3溶液,通入CO2发生CO2+CO32-+H2O=2HCO3-;根据图可知解吸过程为吸热过程,则吸收CO2过程为放出能量的过程;
(2)a.吸收前溶液为Na2CO3,Na2CO3为强碱弱酸盐,CO32-发生水解,溶液显碱性,离子浓度大小顺序是c(Na+)>c(CO32-)> c(OH-)>c(HCO3-)> c(H+),故a错误;
b.根据图,可知吸收CO2时,溶液中溶解了部分CO2,所以吸收过程中,体系中的含碳微粒除了CO32-、HCO3-、H2CO3外,还有CO2分子,故b错误;
c.当n(CO2):n(Na2CO3)=1:3,发生的反应有CO2+CO32-+H2O=2HCO3-,1molCO2能消耗1molCO32-,生成2molHCO3-,生成HCO3-的物质的量等于剩余CO32-的物质的量,但CO32-水解程度大于HCO3-水解,因此c(HCO3-)>c(CO32-),故c正确;
d.根据电荷守恒,溶液中始终有c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故d正确;
故答案选cd;
(3)①C2H4(g)+3O2(g)=2CO2(g)+2H2O(g),②2H2(g)+O2(g)=2H2O(g),根据目标反应方程式,因此有3×②-①,得出△H3=3×△H2-△H1=[3×(-483.6)-(-1323)]kJ·mol-1=-127.8kJ·mol-1;
(4)①250℃时,CO2的转化率为50%,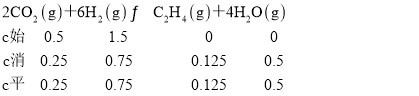 ,化学平衡常数K=
,化学平衡常数K=![]() =
=![]() ;
;
②由曲线b可知,M1点CO2的平衡转化率小于50%,说明反应逆向移动,其他条件不变时,减小n(H2)可使反应逆向移动,CO2的平衡转化率降低,所以![]() <3;
<3;
③A.平衡常数只受温度的影响,M和M1的温度相同,则化学平衡常数:M=M1,该反应为放热反应,升高温度,平衡向逆反应方向移动,化学平衡常数减少,即M1>N,从而得出M=M1>N;故A错误;
B.加入催化剂,反应速率加快,但平衡不移动,故B错误;
C.恒容状态下,反应物生成物均为气体,气体质量不变,容器的体积不变,密度恒为定值,不能作为是否达到平衡的判断依据,故C错误;
D.由图可知,催化剂催化效率随温度升高先增大后降低,温度为250℃左右时,催化效率最高,则工业生产中采取较高温度是为了提高催化剂活性加快反应速率,故D正确。
故答案选D。


科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液滴加到HA溶液中,测得混合溶液的pH与p![]() 转化关系如图所示[已知:p
转化关系如图所示[已知:p![]() =-lg
=-lg![]() ]。下列叙述错误的是( )
]。下列叙述错误的是( )

A.m点:c(A-)=c(HA)
B.Ka(HA)的数量级为10-6
C.水的电离程度:m<r
D.r点:c(H+)+c(Na+)=c(A-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4=HBr+NaHSO4 ①
R-OH+HBr![]() R-Br+H2O ②
R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答:
(1)得到的溴乙烷中含有少量乙醇,为了制得纯净的溴乙烷,可用蒸馏水洗涤,分液后,再加入无水CaCl2,然后进行的实验操作是___(填字母)。
a.分液 b.蒸馏 c.萃取 d.过滤
(2)溴乙烷的水溶性___乙醇(填“大于”、“等于”或“小于”),其原因是___。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在___(填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是___(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)为了检验溴乙烷中含有溴元素,通常采用的方法是:取少量溴乙烷,然后进行下列操作:①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液。下列操作顺序合理的是___(填字母)。
a.①②③④ b.②③①④ c.④①③② d. ①④②③
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病。某课题组以一种含砷精矿石粉(主要成份为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3,工艺流程图如下:
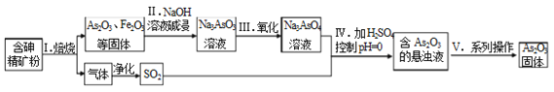
(1)过程 I 中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是_______。
A 工业制硫酸 B 漂白纸张 C 自来水消毒
(2)过程II中发生的反应_______氧化还原反应(填“是”或“不是”)。
(3)过程V中操作为_______(填实验基本操作名称)。
(4)①检验Na3AsO3溶液中是否含有Fe3+的实验操作_______。
②过程IV中生成As2O3的离子反应方程式为_______。
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-。用石墨为电极,在强碱性溶液中电解含AsO33-的溶液,阳极的电极反应式为_______。
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液100mL。
b.分别移取25.00mL上述溶液,用0.02500mol·L1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2 标准溶液液面读数如图二~图四所示。
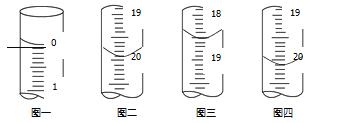
①描述滴定终点的现象_______。
②粗产品中As2O3的质量分数为_______(用含有m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶无色溶液,可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 离子中的几种.为确定其成分,进行如下实验:
离子中的几种.为确定其成分,进行如下实验:![]() 取少许溶液,逐渐加入过量的
取少许溶液,逐渐加入过量的![]() 固体,产生无色无味的气体和白色沉淀且白色沉淀逐渐增多后又部分溶解;
固体,产生无色无味的气体和白色沉淀且白色沉淀逐渐增多后又部分溶解;![]() 另取部分溶液,加入
另取部分溶液,加入![]() 酸化的
酸化的![]() 溶液,有白色沉淀产生;
溶液,有白色沉淀产生;![]() 用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰.下列推断正确的是
用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰.下列推断正确的是![]()
A.肯定有![]() 、
、![]() 、
、![]() 、
、![]()
B.肯定有![]() 、
、![]() 、
、![]() 、
、![]()
C.肯定没有![]() 、
、![]() 、
、![]()
D.肯定没有![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L某混合溶液,只可能含有下表中的若干种离子:
可能大量含有的阳离子 |
|
可能大量含有的阴离子 |
|
当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是![]()
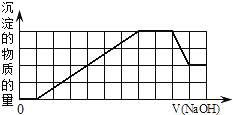
A.原溶液中加入盐酸有沉淀生成
B.原溶液中一定含有![]() 和
和![]()
C.反应最后得到的沉淀只有![]()
D.反应最后形成的溶液中溶质只有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO,反应物和产物的相关数据列表如下:
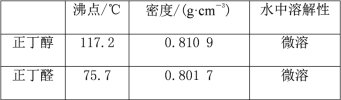
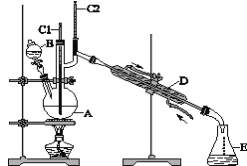
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,与5mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为__________。
(2)加入沸石的作用是_______________。 若加热后发现未加沸石,应采取的正确方法是_________。
(3)上述装置图中,D仪器的名称是______________,E仪器的名称是_______。
(4)分液漏斗使用前必须进行的操作是_________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛在_______层(填“上”或“下”)。
(6)本实验中,正丁醛的产率为_______%(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是

A. HS-在硫氧化菌作用下转化为SO42-的反应为:HS-+4H2O-8e-== SO42-+9H+
B. 电子从b流出,经外电路流向a
C. 如果将反应物直接燃烧,能量的利用率不会变化
D. 若该电池电路中有0.4mol电子发生转移,则有0.45molH+通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:① C(s) + O2(g)=CO2(g) H=-393.5 kJmol-1
②2CO(g) + O2(g)=2CO2(g) H=-566 kJmol-1
③TiO2(s) + 2Cl2(g)=TiCl4(s) + O2(g) H=+141 kJmol-1
则TiO2(s) + 2Cl2(g) + 2C(s)=TiCl4(s) + 2CO(g)的H=_________________。
(2)氯化银在水中存在沉淀溶解平衡AgCl(s)![]() Ag+(aq) + Cl-(aq)。25℃时,氯化银的Ksp=1.8×10-10,现将足量的氯化银加入到0.1 molL-1氯化铝溶液中,银离子浓度最大可达到_____________molL-1。
Ag+(aq) + Cl-(aq)。25℃时,氯化银的Ksp=1.8×10-10,现将足量的氯化银加入到0.1 molL-1氯化铝溶液中,银离子浓度最大可达到_____________molL-1。
(3)20 ℃时,0.1 molL-1 NH4Al(SO4)2溶液的pH=3,则:2c(SO42-)-c(NH4+)-3c(Al3+)≈______________molL-1(填数值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com