


科目:高中化学 来源: 题型:
| A、所用NaOH已潮解 |
| B、向容量瓶加水时不慎超过了刻度线 |
| C、向容量瓶加水时眼睛一直俯视液面 |
| D、转移NaOH溶液后的烧杯没有洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合金的熔点一般比组分金属高 |
| B、合金中只含金属元素 |
| C、合金的机械性能一般比组分金属好 |
| D、合金不容易发生电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉溶液中加入淀粉酶,再加入银氨溶液,出现银镜,说明淀粉已经全部水解 |
| B、除去苯中混有的苯酚,加浓溴水,然后过滤 |
| C、向澄清的苯酚钠溶液中通入CO2,可以看到澄清的溶液变浑浊 |
| D、可用水鉴别苯、四氯化碳、乙醇三种无色液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
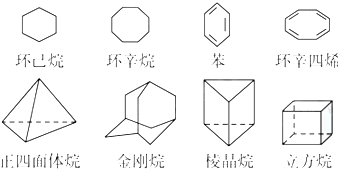
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v (O2)=0.01mol?(L?s) -1 |
| B、v (NO)=0.008mol?(L?s) -1 |
| C、v (H2O)=0.006mol?(L?s) -1 |
| D、v (NH3)=0.002mol?(L?s) -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH<7的溶液一定显酸性 |
| B、25℃时,pH=5的溶液与pH=3的溶液相比,前者c(OH-)是后者的100倍 |
| C、室温下,每1×107个水分子中只有一个水分子发生电离 |
| D、在0.1mol/L的氨水中,改变外界条件使c(NH4+)增大,则溶液的pH一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com