
| A. | 1H、2H、3H互为同素异形体 | |
| B. | H2S分子中的化学键为非极性共价键 | |
| C. | S2-的结构示意图: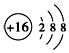 | |
| D. | NH4Cl的电子式: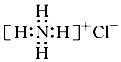 |
分析 A.同素异形体的研究对象为单质;
B.H2S为共价化合物,只含有极性共价键;
C.S2-核外电子数为18;
D.根据电子式的书写方法来回答.
解答 解:A.1H、2H、3H具有相同质子数、不同中子数,二者互为同位素,故A错误;
B.H2S为共价化合物,只含有极性共价键,故B错误;
C.S2-核外电子数为16+2=18,M层应含有8个电子,故S2-的结构示意图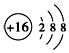 ,故C正确;
,故C正确;
D.氯化铵的电子式为: ,故D错误,
,故D错误,
故选C.
点评 本题考查常见化学用语的表示方法,题目难度不大,涉及同位素、化学键、离子结构示意图、电子式等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的规范答题能力.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:实验题
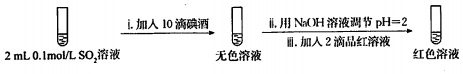
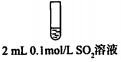
 | 试管中的溶液 | 现象 |
| a.0.1mol/LSO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
| b.0.1mol/LNaHSO3溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
| c.0.1mol/LNa2SO3溶液(pH=10) | 溶液立即褪色 | |
| d.pH=10NaOH溶液 | 红色溶液不变色 | |
| e.pH=2H2SO4溶液 | 红色溶液不变色 |
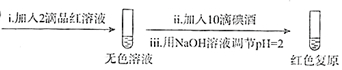
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将AgCl、AgBr饱和溶液等体积混合后,滴加足量的硝酸银溶液,其主要沉淀物为AgBr | |
| B. | 常温下,浓度为0.1mol•L-1的HA溶液(Ka=10-5)pH≈3 | |
| C. | c(SO32-)相等的Na2SO3溶液、NaHSO3溶液、H2SO3溶液的浓度:c(NaHSO3)>c(H2SO3)>c(Na2SO3) | |
| D. | 25℃时,向10mL0.01mol•L-1KOH溶液中滴加10mL0.01mol•L-1的醋酸溶液后,混合液中:c(K+)>c(CH3COO-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将△H<0的氧化还原反应设计成原电池,将化学能转变为电能 | |
| B. | 轮船水线以下的船壳上,嵌一定数量的锌块,保护船体不被腐蚀 | |
| C. | 在锌与稀硫酸反应的溶液中加入少量CuSO4,能加快生成H2的速率 | |
| D. | 为了保护地下钢管不受腐蚀,将它与一定电压的直流电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cu、Ag、AgNO3溶液 | B. | Zn、Cu、稀硫酸 | ||
| C. | Fe、Zn、CuSO4溶液 | D. | Fe、C、Fe2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由12C、16O、14N组成的44gCO2和44gN2O中含有的中子数均为22NA | |
| B. | 2L 0.5mol/L亚硫氢硫酸钠溶液中含有的HSO3-离子数为NA | |
| C. | 氢氧化钠与氯气反应时,生成0.1molNaCl时转移的电子数等于0.2NA | |
| D. | 适当条件下2molSO2与2molO2充分反应,反应体系中最终的气体分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
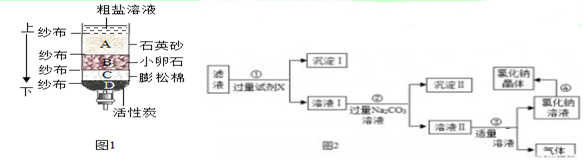
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室从海带中提取单质碘的方法是:取样→灼烧→溶解→萃取 | |
| B. | 不能通过“玻璃棒蘸取某溶液做焰色反应实验时火焰呈黄色”说明该溶液中含钠元素 | |
| C. | 配制浓硫酸、浓硝酸的混酸时,应将浓硝酸沿玻璃棒缓慢注入浓硫酸中 | |
| D. | 测氯水的pH时,可用干燥洁净的玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com