
| 编号 | 实验目的 | 实验设计 |
| A | 证明盐酸酸性比醋酸强 | 用同一电路测等体积盐酸、醋酸溶液的导电性 |
| B | 证明H2CO3酸性比H2SiO3强 | 将CO2通入Na2SiO3溶液中 |
| C | 证明钠的金属活动性比铜强 | 向CuCl2溶液中投入金属钠 |
| D | 证明溶液中含有I- | 往溶液中加入淀粉 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体 |
| B、测定工业烧碱的含量(含杂质碳酸钠)可称取一定量样品放人锥形瓶中,加适量水溶解,再加入稍过量氯化钡溶液,用酚酞作指示剂,用标准浓度的盐酸滴定 |
| C、用分液漏斗分离苯与硝基苯 |
| D、除去氯化铁酸性溶液中的氯化亚铁:加入适量的过氧化氢水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
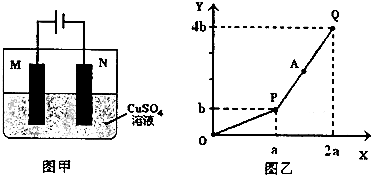
| A、电解过程中N电极表面先有红色物质生成,后有气泡产生 |
| B、A点所得溶液只需加入一定量的CuO固体就可恢复到起始状态 |
| C、Q点时M、N两电极上产生的气体在相同条件下体积相同 |
| D、若M电极材料换成Cu做电极,则电解过程中CuSO4溶液的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4HSO3溶于过量的NaOH溶液中:HSO3-+OH-=SO32-+H2O |
| B、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| C、Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O |
| D、酸性KMnO4溶液与双氧水溶液反应:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
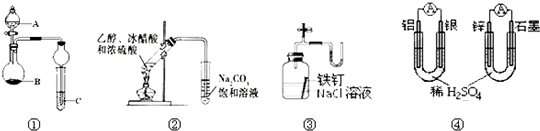
| A、图①中,若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色 |
| B、图②制备乙酸乙酯 |
| C、图③证明铁生锈与空气有关 |
| D、图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量氯气和溴化亚铁溶液反应:C12+2Br-=2Cl-+Br2 |
| B、氢氧化钡溶液中加入少量的硫酸氢钠溶液:Ba2++H++OH-+SO42-=BaSO4↓+H2O |
| C、蛋壳溶于食醋中:CaCO3+2H+=Ca2++CO2↑+H2O |
| D、金属钠投入硫酸铜溶液中:2Na+Cu2+=Cu+2Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com