
【题目】【衡阳市2017届下学期第三次联考】Na2S2O5常用作纺织业棉麻脱氯剂;酸化时可放出SO2气体。其制备工艺流程如下:

(1)Na2S2O5的名称为_______________(选填“焦硫酸钠”或“焦亚硫酸钠”)。
(2)“反应I ”中应先通入的气体是_____,反应后析出的固体产物是____________。
(3)“反应II”的化学方程式为_________________________。
(4)若反应条件或用量等控制不当,则所得的Na2S2O5产品中往往含有杂质。
①若产品中含有杂质Na2SO3,其具体原因可能是______________(任答一条即可);
②若检验产品中含有杂质Na2SO3,下列试剂的使用顺序依次为_________(填编号)。
A.稀硫酸 B.澄淸石灰水 C.品红溶液 D.酸性KMnO4溶液
(5)Na2S2O3也可用作棉麻的脱氯剂。
①Na2S2O5溶液与Cl2反应的离子方程式为____________________;
②Na2S2O5与Na2S2O3脱氯等效时,消耗二者的质量之比为____________。
【答案】焦亚硫酸钠 NH3(或:氨气) NaHCO3(或:碳酸氢钠) Na2CO3+2SO2+H2O=2NaHSO3+CO2↑ 反应II中SO2的用量不足:NaHSO3分解时反应温度不高 a d c b S2O52-+2Cl2+3H2O==6H++2SO42-+4C1- 190:79(或:2.4:1)
【解析】该原理为:反应Ⅰ为生成NaHCO3,加热生成Na2CO3,在反应Ⅱ中二氧化硫与碳酸钠反应生成NaHSO3与二氧化碳,加热NaHSO3生成Na2S2O5。
(1)S为+4价, Na2S2O5的名称为焦亚硫酸钠;(2)工艺流程可知,反应Ⅰ为生成NaHCO3,氯化钠溶液通入氨气、二氧化碳生成碳酸氢钠与氯化铵,反应方程式为:CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;反应Ⅰ进行时应先通入氨气,增大HCO3-的浓度,便于NaHCO3析出;(3) “反应II”的化学方程式为Na2CO3+2SO2+H2O=2NaHSO3+CO2↑ (4)反应Ⅱ中发生反应Na2CO3+H2O+2SO2=2NaHSO3+CO2↑,2NaHSO3![]() Na2S2O5+H2O,故SO2与Na2CO3的物质的量之比接近2:1恰好完全反应,若SO2不足Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低,①若产品中含有杂质Na2SO3,其具体原因可能是:反应II中SO2的用量不足:NaHSO3分解时反应温度不高。②产品中可能含有杂质Na2SO3、Na2CO3,A.加稀硫酸产生SO2、CO2,通入D.酸性KMnO4溶液,除去SO2,再通入 C.品红溶液,确定SO2已除尽,最后再通入 B.澄淸石灰水,检验CO2。故试剂的使用顺序依次为a d c b;(5)①Na2S2O5溶液与Cl2反应的离子方程式为 S2O52-+2Cl2+3H2O==6H++2SO42-+4C1- ,S2O32-+4Cl2+5H2O==10H++2SO42-+8C1- ,由方程式可知,当Cl2相同时,2Na2 S2O5~Na2S2O3,消耗二者的质量之比为190×2:158=190:79(或:2.4:1)。
Na2S2O5+H2O,故SO2与Na2CO3的物质的量之比接近2:1恰好完全反应,若SO2不足Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低,①若产品中含有杂质Na2SO3,其具体原因可能是:反应II中SO2的用量不足:NaHSO3分解时反应温度不高。②产品中可能含有杂质Na2SO3、Na2CO3,A.加稀硫酸产生SO2、CO2,通入D.酸性KMnO4溶液,除去SO2,再通入 C.品红溶液,确定SO2已除尽,最后再通入 B.澄淸石灰水,检验CO2。故试剂的使用顺序依次为a d c b;(5)①Na2S2O5溶液与Cl2反应的离子方程式为 S2O52-+2Cl2+3H2O==6H++2SO42-+4C1- ,S2O32-+4Cl2+5H2O==10H++2SO42-+8C1- ,由方程式可知,当Cl2相同时,2Na2 S2O5~Na2S2O3,消耗二者的质量之比为190×2:158=190:79(或:2.4:1)。


科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。
(1)操作①的名称是_________。
(2)试剂a是_________,试剂b 是_________ 。
(3)加入试剂a所发生反应的离子方程式为_________。
加入试剂b所发生反应的离子方程式为_________。
(4)该方案能否达到实验目的:_____(填“能”或“不能”)。若不能,应如何改进? _____(若能,此问不用回答).
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外。至少还要获得的数据是_________的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【合肥市2017届第三次教学模拟】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2.

实验操作和现象如下表:
实验编号 | 操作 | 现象 |
实验1 | 按上图所示加热MnO2与FeCl3·6H2O 混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
实验2 | 把A中的混合物换为FeC13·6H2O, B中溶液换为KSCN溶液,加热。 | A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红 |
回答下列问题:
(l)上述实验中的白雾是_______;试管A管口向上倾斜的原因是_________
(2)实验2说明黄色气体中含有FeCl3,写出FeCl3使KI-淀粉溶液变蓝的离子方程式:___
(3)为进一步确认黄色气体中含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在A、B间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色。
方案2:将B中KI一淀粉溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+。则方案1 C中盛放的试剂是_________;方案2中检验Fe2+的试剂是______,选择NaBr溶液的依据是______。
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为_______;其尾气处理的方法是_________。
(5)该学习小组认为实验1 中溶液变蓝,可能还有另外一种原因是:________________________。请你设计实验方案验证此猜想:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。
Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是________。
Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O他们利用该反应设计如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O他们利用该反应设计如下制取氯气并验证其性质的实验。

回答下列问题:(1)该实验中A部分的装置是_______(填标号)。
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):_____________________________。
(3)写出D装置中发生反应的离子方程式_________________
(4)该实验存在明显的缺陷,请你提出改进的方法__________________________________________写出反应离子方程式_____________________________________。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取出25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol.L1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为:2Na2S2O3+I2===Na2S4O6+2NaI,共用去Na2S2O3溶液20.0 mL。则该漂白粉中Ca(ClO)2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。
![]()
![]()
![]()
![]()
![]()
回答下列问题:
(1)为尽量少引入杂质,试剂①应选用NaOH溶液,若选用H2SO4溶液,其后果是________________________ 。
(2)易拉罐溶解过程中主要反应的化学方程式为____________________________;滤液A中的某种离子与NH4+、HCO3-均能反应生成沉淀B,该离子与NH4+反应的离子方程式为_____________________________________________。
(3)明矾与硫磺焙烧时发生反应的化学方程式为:KAl(SO4)2·12H2O+S![]() K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为___________________________;每生成67.2L标准状况下的SO2,转移电子的物质的量为________;焙烧产生的SO2经催化氧化、吸收等过程可制得硫酸,若SO2催化氧化时的转化率为96.0%,则理论上用该法生成硫酸时硫元素的总转化率为__________。
K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为___________________________;每生成67.2L标准状况下的SO2,转移电子的物质的量为________;焙烧产生的SO2经催化氧化、吸收等过程可制得硫酸,若SO2催化氧化时的转化率为96.0%,则理论上用该法生成硫酸时硫元素的总转化率为__________。
(4)实验室需要用1mol/L的KAl(SO4)2溶液225ml,用明矾配制用到的玻璃仪器有____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在任何条件下,纯水显中性,这是因为 ( )
A、PH=7 B、c(H+)=c(OH-)
C、c(H+)=c(OH-)=10-7mol/L D、c(H+)×c(OH-)=10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅱ]水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2![]() +I2=2I+
+I2=2I+![]() )。
)。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2)“氧的固定”中发生反应的化学方程式为_______________。
(3)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和____________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____及二氧化碳。
(4)取100.00 mL水样经固氧、酸化后,用a mol·L1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为_________mg·L1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________。(填“高”或“低”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【合肥市2017届第三次模拟考试】对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。
Ⅰ.CO还原法
(1)一定条件下,由SO2和CO反应生成S和CO2的能量变化如右图I所示,每生成16gS(s) ,该反应_______(填“放出”或“吸收”)的热量为_________。
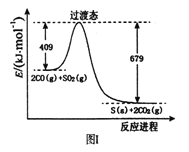
(2)在绝热恒容的密闭容器中,进行反应:
2CO(g)+SO2(g) ![]() S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
A.若混合气体密度保持不变,则已达平衡状态
B.反应开始到平衡时,容器内气体的压强保持不变
C.达平衡后若再充人一定量CO2,平衡常数保持不变
D.分离出S,正、逆反应速率均保持不变
(3)向2L恒温恒容密闭容器中通入2molCO和lmolSO2,分别进行a、b、c三组实验。在不同条件下发生反应:2CO(g)+SO2(g)![]() S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
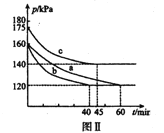
Ⅱ.Na2SO3溶液吸收法
常温下,用300mL1.0mol·L-1,Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线如上图Ⅲ所示。
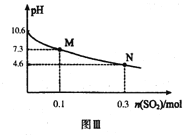
(4)1.0mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________
(5)若用等体积、等物质的量浓度的下列溶液分别吸收SO2,则理论上吸收量最多的是____
A.NH3·H2O B.Na2S C.Na2CO3 D.FeCl3
(6)常温下,H2SO3的二级电离平衡常数Ka2的数值为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com