
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为_____________________;Al与NaOH溶液反应的离子方程式为
________________________________________________。
(2)30Si的原子的中子数为_________;SiO2晶体类型为__________________。
(3)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是__________。
(5)经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0g固体;滤液中加入过量NaOH溶液,分离得到21.4g固体;则此熔渣中Al2O3的质量分数为__________________。
【解析】本题考察原子的结构、晶体类型、方程式的书写以及有关计算。
(1)Al在周期表中位于第三周期第ⅢA族,其原子结构示意图为 ;单质铝既能与酸反应产生氢气,又能与强碱反应产生氢气,与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。
;单质铝既能与酸反应产生氢气,又能与强碱反应产生氢气,与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。
(2)在原子符合的表达式中左上角表示质量数,左下角表示质子数,根据质量数=质子数+中子数可计算出30Si的原子的中子数为:30-14=16。SiO2晶体是由Si和O两种原子通过极性共价键形成的原子晶体。
(3)在元素周期表中只有第 ⅦA族卤素原子的 氢化物的水溶液才均显酸性,因为Al3+与Yn-的电子数相同,所以Y是F元素。卤素元素形
氢化物的水溶液才均显酸性,因为Al3+与Yn-的电子数相同,所以Y是F元素。卤素元素形 成的氢化物均属于分子晶体,其沸点随分子间作用力的增大而升高,但由于HF分子中存在氢键,因而HF的沸点最高,所以沸点最低的是HCl。
成的氢化物均属于分子晶体,其沸点随分子间作用力的增大而升高,但由于HF分子中存在氢键,因而HF的沸点最高,所以沸点最低的是HCl。
(4)由药皮的成分大理石、水泥、硅铁可知,在高温下只有大理石才分解产生CO2,因此气体只能是CO2气体。
(5)熔渣中只有SiO2与盐酸不反应,因此11.0g是SiO2的质量。Fe2O3、Al2O3溶于盐酸分别生成FeCl3、AlCl3,当滤液中加入过量NaOH溶液时AlCl3生成NaAlO2,FeCl3生成Fe(OH)3沉淀。所以21.4g固体是Fe(OH)3的质量,其物质的量为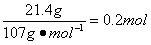 ,由铁原子守恒知Fe2O3的物质的量为0.1mol,其质量为0.1mol×160g·mol-1=16.0g。熔渣中Al2O3的质量分数为
,由铁原子守恒知Fe2O3的物质的量为0.1mol,其质量为0.1mol×160g·mol-1=16.0g。熔渣中Al2O3的质量分数为 。
。
【答案】(1) 2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)16 原子晶体
(3)HCl
(4)CO2
(5)25%


科目:高中化学 来源: 题型:
溶液、胶体和浊液这三种分散系的根本区别是 ( )
A.是否大量分子或离子的集合体 B.分散质粒子直径的大小
C.是否能通过滤纸或半透膜 D.是否均一、稳定、透明
查看答案和解析>>
科目:高中化学 来源: 题型:
374℃、22.1Mpa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水
A.显中性,pH等于7 B.表现出非极性溶剂的特性
C.显酸性,pH小于7 D.表现出极性溶剂的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N -N-N键角都是108.1°,下列有关N(NO2) 3的说法正确的是
-N-N键角都是108.1°,下列有关N(NO2) 3的说法正确的是
A.分子中N、O间形成的共价键是非极性键
B.分子中四个氮原子共平面
C.该物质既有氧化性又有还原性
D.15.2g该物质含有6.02×1022个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.分子晶体中一定存在分子间作用力,不一定存在共价键
B.分子中含两个氢原子的酸一定是二元酸
C.含有金属离子的晶体一定是离子晶体
D.元素的非金属型越强,其单质的活泼型一定越强
查看答案和解析>>
科目:高中化学 来源: 题型:
下面关于SiO2晶体网状结构的叙述正确的是
A.存在四面体结构单元,O处于中心,Si处于4个顶角
B.最小的环上,有3个Si原子和3个O原子
C.最小的环上,Si和O原子数之比为1:2
D.最小的环上,有6个Si原子和6个O原子
查看答案和解析>>
科目:高中化学 来源: 题型:
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.乙炔是有机合成工业的一种原料。工业上曾用 与水反应生成乙炔。
与水反应生成乙炔。
(1)  中
中 与
与 互为等电子体,
互为等电子体, 的电子式可表示为 ;1mol
的电子式可表示为 ;1mol  中含有的
中含有的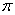 键数目为 。
键数目为 。
 (2)将乙炔通入
(2)将乙炔通入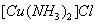 溶液生成
溶液生成 红棕色沉淀。
红棕色沉淀。 基态核外电子排布式为 。
基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈 。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
(4)  晶体的晶胞结构与
晶体的晶胞结构与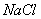 晶体的相似(如右图所示),但
晶体的相似(如右图所示),但 晶体中含有的中哑铃形
晶体中含有的中哑铃形 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。 晶体中1个
晶体中1个 周围距离最近的
周围距离最近的 数目为 。
数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据陈述的知识,类推得出的结论正确的是( )
A.镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O
B.乙烯可使酸性高锰酸钾溶液褪色,则丙烯也可以使其褪色
C.CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似
D.金刚石的硬度大,则C60的硬度也大
查看答案和解析>>
科目:高中化学 来源: 题型:
用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子), 请回答:
请回答:
(1)A元素是__________、B元素是__________、C元素是__________(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是__________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是__________。
(4)F是由两种元素组成的三原子分子,其分子式是__________,电子式是__________。
(5)G分子中含有4个原子,其分子式是__________。
(6)H分子中含有8个原子,其分子式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com