
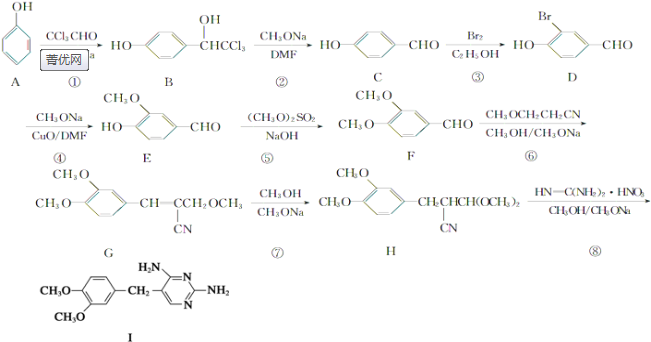
 的副产物,为了使该产物的含量降到最低,需要合成路线中第
的副产物,为了使该产物的含量降到最低,需要合成路线中第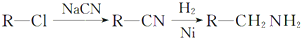 .化合物
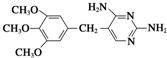
.化合物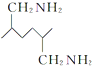 是合成染料的中间体,请写出以氯乙烷为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH
是合成染料的中间体,请写出以氯乙烷为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH| 浓硫酸 |
| 170℃ |
| 高温高压 |
| 催化剂 |
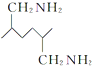 ,则要得到
,则要得到 ,结合流程反应①的反应,则要得到
,结合流程反应①的反应,则要得到 ,必须得到CH3CH2CN和OHCCHO,结合氯乙烷为原料制备CH3CH2CN和OHCCHO即可,所以具体流程为
,必须得到CH3CH2CN和OHCCHO,结合氯乙烷为原料制备CH3CH2CN和OHCCHO即可,所以具体流程为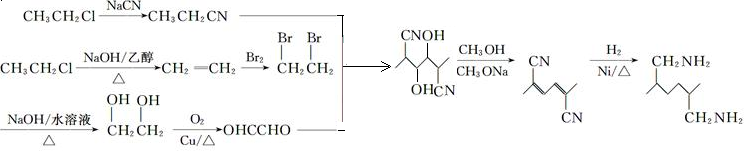 .
.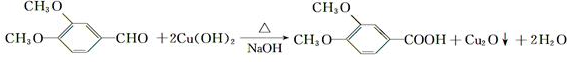 ,故答案为:
,故答案为: ;
; ,故答案为:
,故答案为: ;
; 的副产物比二甲氧苄胺嘧啶的结构左边的苯环上多一个甲氧基,则第③步应控制溴原子只取代一个邻位,所以为了使该产物的含量降到最低,需要合成路线中第③步进行优化,故答案为:③;
的副产物比二甲氧苄胺嘧啶的结构左边的苯环上多一个甲氧基,则第③步应控制溴原子只取代一个邻位,所以为了使该产物的含量降到最低,需要合成路线中第③步进行优化,故答案为:③;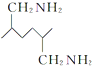 ,则要得到
,则要得到 ,结合流程反应①的反应,则要得到
,结合流程反应①的反应,则要得到 ,必须得到CH3CH2CN和OHCCHO,结合氯乙烷为原料制备CH3CH2CN和OHCCHO即可,所以具体流程为:
,必须得到CH3CH2CN和OHCCHO,结合氯乙烷为原料制备CH3CH2CN和OHCCHO即可,所以具体流程为: ,
, .
.


科目:高中化学 来源: 题型:
| A、x+y<n |
| B、该化学平衡向右移动 |
| C、B的转化率增大 |
| D、C的体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲醛(HCHO) |
| B、苯(C6H6) |
| C、甲苯(C7H8) |
| D、一氧化碳(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
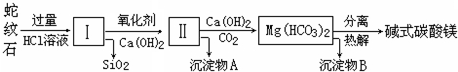
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
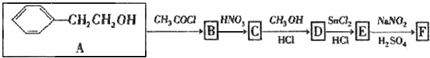
| HCl |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用量筒量取5.00mL 1.00mol?L-1盐酸于50mL容量瓶中,加水稀释至刻度可配制0.100mol?L-1盐酸 |
| B、用10mL的量筒准确量取9.50mL水 |
| C、向碘水中加入CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
| D、稀释浓硫酸时将水倒入浓硫酸中进行搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
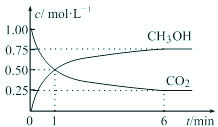 我国政府承诺,到2020年,单位GDP二氧化碳排放量比2005年下降40%~50%.
我国政府承诺,到2020年,单位GDP二氧化碳排放量比2005年下降40%~50%.
| ||
| ||
| ||
| 太阳光 |
| ||
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com