
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)用单线桥法表示该反应电子转移的方向和数目:___________。
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是___________,转移电子的数目是_____________。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 _________________________ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_________________________。
【答案】 2 mol 2NA 或1.204×1024 4Cl2+8NaOH == 6NaCl+NaClO3+NaClO+4H2O Cl-+ClO-+2H+ == Cl2↑+H2O
2 mol 2NA 或1.204×1024 4Cl2+8NaOH == 6NaCl+NaClO3+NaClO+4H2O Cl-+ClO-+2H+ == Cl2↑+H2O
【解析】
(1)![]() 中,HCl作还原剂,失去电子,MnO2作氧化剂,得到电子,单线桥法是由失电子的元素指向得电子的元素的一种方法,该反应中Mn从+4降低到+2,得到两个电子,答案为
中,HCl作还原剂,失去电子,MnO2作氧化剂,得到电子,单线桥法是由失电子的元素指向得电子的元素的一种方法,该反应中Mn从+4降低到+2,得到两个电子,答案为
(2)4molHCl参加反应,但是Cl元素化合价只有一半升高,也即2molHCl做还原剂,被氧化为1molCl2,转移2mol电子,即2NA 或1.204×1024。
(3)该反应为氧化还原反应,根据失电子数等于得电子数及有化合价升高就有化合价降低的原理可知,Cl元素的另一种产物为NaCl,从而可写出:
4Cl2+8NaOH == 6NaCl+NaClO3+NaClO+4H2O
(4)Cl-有还原性、ClO-有氧化性,在酸性条件下发生氧化还原反应生产Cl2:Cl-+ClO-+2H+ == Cl2↑+H2O


科目:高中化学 来源: 题型:
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:
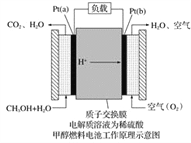
请回答下列问题:
(1)Pt(a)电极是电池的________极,电极反应式为__________________;Pt(b)电极发生________(填“氧化”或“还原”)反应,电极反应式为___________。
(2)电池的总反应方程式为____________________。
(3)如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | NaOH溶液 | SiO2 | 浓盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2在一定条件下发生反应: N2(g) +3H2(g)![]() 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=___________。平衡时H2的转化率为__________。
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=___________。平衡时H2的转化率为__________。
(2)平衡后,若提高H2的转化率,可以采取的措施有____________________。
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1_________________K2(填“<”“>”或“=” );
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(N2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g) ![]() N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
温度/℃ | c(NH3·H2O) /(mol·L-1) | 电离常数 | 电离度/% | c(OH-) /(mol·L-1) |
0 | 16.56 | 1.37×10-5 | 9.098 | 1.507×10-2 |
10 | 15.16 | 1.57×10-5 | 10.18 | 1.543×10-2 |
20 | 13.63 | 1.71×10-5 | 11.2 | 1.527×10-2 |
提示:![]()
(1)温度升高,NH3·H2O的电离平衡向________(填“左”或“右”)移动,能支持该结论的表中数据是________(填字母)。
a.电离常数 b.电离度 c.c(OH-) d.c(NH3·H2O)
(2)表中c(OH-)基本不变的原因是__________________________________。
(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是_______(填字母,下同)。
A.溶液的pH增大 B.氨水的电离度减小 C.c(OH-)减小 D.c(NH4+)减小
(4)氨水溶液中,下列做法能使c(NH4+)与c(OH-)比值变大的是________。
A.加入固体氯化铵 B.通入少量氯化氢
C.降低溶液温度 D.加入少量固体氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 的物质的量浓度相等的下列溶液:①(NH4)2SO4 ② (NH4)2Fe(SO4)2 ③(NH4)2CO3,溶质的物质的量浓度由大到小的顺序为
的物质的量浓度相等的下列溶液:①(NH4)2SO4 ② (NH4)2Fe(SO4)2 ③(NH4)2CO3,溶质的物质的量浓度由大到小的顺序为
A. ① > ② > ③ B. ③ > ① > ②
C. ③ > ② > ① D. ② > ① > ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡(SnCl4)是合成有机锡化合物的原料,其熔点为-33℃,沸点为114℃,在潮湿的空气中强烈水解产生有刺激性的白色烟雾,产物之一为SnO2。实验室制备四氯化锡的操作是:将金属锡熔融,然后泼入冷水,制成锡花;将干燥的锡花加入反应器中,再向反应器中缓慢地通入干燥的氯气。(装置C中的试剂Ⅹ未画出)
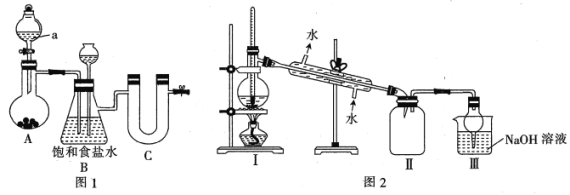
I.图1为实验室制备干燥氯气的实验装置(夹持装置已略)
(1)该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO2]和浓盐酸,A中发生反应的化学方程式为_________________________________。
(2)装置B中的饱和食盐水能够除去Cl2中的HCl,此外还有___________作用。
(3)试剂Ⅹ可能为___________(填标号)。
A.无水氯化钙 B.浓硫酸 C.五氧化二磷 D.碱石灰
(4)用锡花代替锡粒的目的是_________________________________。
(5)四氯化锡在潮湿空气中水解的化学方程式为_________________________________。
Ⅱ.图2是蒸馏SnCl4的装置
(6)该装置尚有两处不当之处,它们分别是____________________、______________________。
(7)实验用的锡花中含有金属铜。某同学设计下列实验测定锡花的纯度:
第一步:称取7.500g锡花溶于足量稀硫酸中,充分反应后过滤;
第二步:向滤液中加入过量Fe2(SO4)3,将生成的Sn2+氧化成Sn4+;
第三步:用0.9500mol·L-1的K2Cr2O7溶液滴定生成的Fe2+,发生反应的方程式为Fe2++Cr2O72-+H+→Cr3++Fe3++H2O(未配平)
若达到滴定终点时共消耗21.00mLK2Cr2O7溶液,试计算锡花中锡的百分含量:___________(结果保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,部分弱酸的电离常数如表。下列有关说法不正确的是
弱酸 | HCOOH | HClO | H2S |
电离平衡常数(Ka) | Ka=1.0×10-4 | Ka=2.0×10-8 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
A. 若 HCOONa和 HCOOH的混合溶液的pH=3,则c(HCOOH)/c(HCOO-)=10
B. 相同浓度的 HCOONa和 NaClO溶液中离子总浓度前者大
C. 任何浓度NaHS溶液中总存在:c(H2S)+c(H+)=c(OH-)+c(S2-)
D. 向 NaClO溶液中通入H2S发生的反应为2C1O-+H2S===S2-+2HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com