

 .
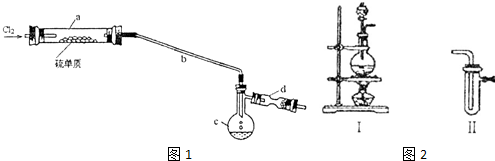
.分析 (1)在铁作催化剂条件下,苯和液溴发生取代反应溴苯,苯与液溴反应生成HBr,HBr遇水蒸气形成白雾;苯的卤代反应是放热反应,液溴易挥发,所以尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气;
(2)溴苯中含有溴,单质溴能与NaOH溶液反应生成NaBr和NaBrO溶于水中,而溴苯不与NaOH溶液反应,也不溶于水,分液后,然后加干燥剂;
(3)根据分离出的粗溴苯中含有未反应的苯,分离互溶的液体,利用沸点不同,可采用蒸馏的方法进行分离;
(4)根据制取溴苯所加的液体的体积以及溶液的体积一般不超容器的$\frac{2}{3}$,不少于$\frac{1}{3}$;
(5)根据质谱图中最右边的那个峰就是该物质的相对分子质量,由商余法确定其分子式;
根据核磁共振氢谱中有4个吸收峰,结合分子式可以判断出应是甲苯,其苯环上的一氯代物有3种.
解答 解:(1)苯与液溴反应生成HBr,HBr遇水蒸气形成白雾;苯的卤代反应是放热反应,液溴易挥发,所以尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气,在铁作催化剂条件下,苯和液溴发生取代反应溴苯,反应方程式为 ,
,
故答案为:HBr;吸收HBr防止产生倒吸; ;
;
(2)溴苯提纯的方法是:先水洗,把可溶物溶解在水中,然后过滤除去未反应的铁屑,再加NaOH溶液,把未反应的Br2变成NaBr和NaBrO洗到水中,然后加干燥剂,无水氯化钙能干燥溴苯,
故答案为:干燥;
(3)反应后得到的溴苯中溶有少量未反应的苯,苯和溴苯互溶,但苯的沸点低,所以采用蒸馏的方法进行分离,溴苯留在母液中,
故答案为:苯;C;
(4)操作过程中,先在a中加入15mL无水苯,在b中小心加入4.0mL液态溴,最后向a中加入10mL水,共约30mL,所以a的容积最适合的是50mL,
故答案为:B;
(5)从质谱图中可以看出该气体的相对分子质量为92,由商余法确定其分子式为C7H8,由核磁共振氢谱中有4个吸收峰,可以判断出应是甲苯,其苯环上的一氯代物有3种(邻、间、对),
故答案为:92;甲苯;3.
点评 本题考查物质制备实验,为高频考点,明确实验原理是解本题关键,知道实验操作步骤及基本操作方法,题目难度中等.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届广西桂林十八中高三上10月月考化学试卷(解析版) 题型:选择题
下列叙述不正确的是( )
A.钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火
B.探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的 反应速率偏高
反应速率偏高
C.蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
D.为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
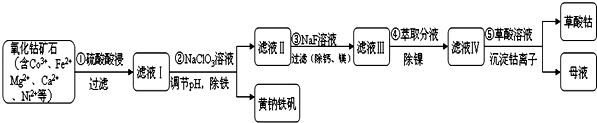
| 序号 | 矿石粒度/目 | 钴浸出率/% |
| 1 | -60 | 9.8 |
| 2 | -120 | 25.5 |
| 3 | -200 | 41.18 |
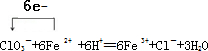 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、NO3-、SO42- | |
| B. | 0.1 mol•L-1Na2S溶液:SO42-、K+、Cl-、Cu2+ | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、Br- | |
| D. | 0.1 mol•L-1NaAlO2 溶液:OH-、Na+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com