
| A | A的一种单质在自然界中硬度最大 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | 同周期中,C元素的最高价氧化物对应的水化物的碱性最强 |
| D | D的基态原子M层电子数是K层的2 倍 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
分析 A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加,A的一种单质在自然界中硬度最大,则A为碳元素;D的基态原子M层电子数是K层的2 倍,则其M层电子数为4,故D为Si;同周期中,C元素的最高价氧化物对应的水化物的碱性最强,处于ⅠA族,原子序数大于碳小于硅,故C为Na;B元素的第一电离能比同周期相邻两个元素都大,处于ⅡA族或ⅤA族,而B的原子序数介于碳、钠之间,故B为N元素;E与C位于不同周期,原子序数大于Si,则E处于第四周期,E原子核外最外层电子数与C相同,其余各层电子均充满,原子核外电子数=2+8+18+1=29,则E为Cu,据此解答.
解答 解:A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加,A的一种单质在自然界中硬度最大,则A为碳元素;D的基态原子M层电子数是K层的2 倍,则其M层电子数为4,故D为Si;同周期中,C元素的最高价氧化物对应的水化物的碱性最强,处于ⅠA族,原子序数大于碳小于硅,故C为Na;B元素的第一电离能比同周期相邻两个元素都大,处于ⅡA族或ⅤA族,而B的原子序数介于碳、钠之间,故B为N元素;E与C位于不同周期,原子序数大于Si,则E处于第四周期,E原子核外最外层电子数与C相同,其余各层电子均充满,原子核外电子数=2+8+18+1=29,则E为Cu.
(1)E为Cu,在周期表中位于第四周期第ⅠB族,
故答案为:四、ⅠB;
(2)A、B、D三元素分别为C、N、Si,同周期随原子序数增大电负性增大,同主族自上而下电负性减小,故电负性由大到小顺序为:N>C>Si,
故答案为:N>C>Si;
(3)A、B的最简单氢化物分别为CH4、NH3,由于NH3分子间存在氢键,其沸点高于CH4的,
故答案为:NH3;NH3分子间存在氢键;
(4)已知:①、CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
②、2NO2(g)?N2O4(g)△H2=-56.9kJ/mol
由盖斯定律,①-②得:CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol,
故答案为:CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol.
点评 本题考查结构性质位置关系应用,题目比较综合,涉及核外电子排布、电负性、热化学方程式等,侧重考查学生对知识的迁移应用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | AgI、AgCl与水混合后形成的分散系中:c(Ag+)=c(I-)>c(C1-) | |
| B. | 25℃时,在pH相等的NH4C1溶液和盐酸中,水的电离程度也相等 | |
| C. | 25℃时,将pH=11的NaOH溶液与pH=3的某弱酸HA的溶液等体积混合,混合后的溶液呈碱性 | |
| D. | 25℃时,在pH=2的H2C2O4 (一种二元弱酸)溶液与pH=12的NaOH溶液以任意比例混合后形成的溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含有等物质的量的Ba(OH)2、KOH、的混合溶液中通入CO2;与CO2反应的物质依次是KOH、Ba(OH)2、BaCO3 | |
| B. | 向含有等物质的量的Fe2+、Ag+、Cu2+ 的混合溶液中加入Zn:与Zn反应的离子依次是Ag+、Cu2+、Fe2+ | |
| C. | 向含有等物质的量的AlO2?、OH-、CO32- 的混合溶液中滴加盐酸:与盐酸反应的物质依次是AlO2-、Al(OH)3、OH-、CO32- | |
| D. | 向含有等物质的量的AlCl3、HCl的混合溶液中滴加NaOH溶液,与NaOH反应的物质依次是AlCl3、HCl、Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
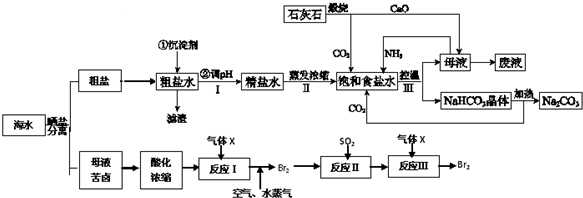
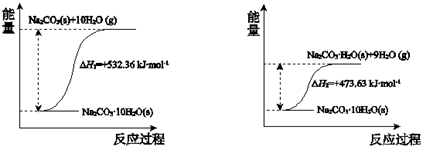
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
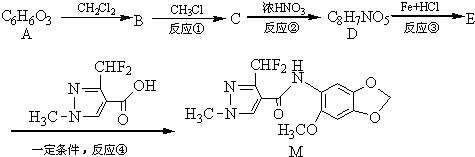
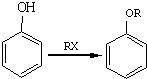
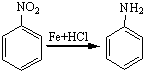
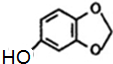 ;A的名称(系统命名)是1,2,4-苯三酚.
;A的名称(系统命名)是1,2,4-苯三酚.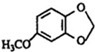 +HNO3(浓)$\stackrel{0℃-5℃}{→}$
+HNO3(浓)$\stackrel{0℃-5℃}{→}$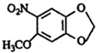 +H2O;反应①和②的先后次序不能颠倒,其原因是B中有酚羟基,若硝化,会被硝酸氧化而降低M的产率.
+H2O;反应①和②的先后次序不能颠倒,其原因是B中有酚羟基,若硝化,会被硝酸氧化而降低M的产率.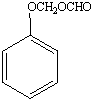 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 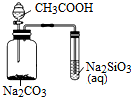 不能用来检验CH3COOH、H2CO3、H2SiO3酸性的强弱 | |
| B. | 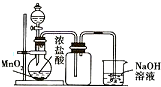 可用来制取并收集氯气 | |
| C. | 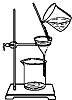 可用来分离氢氧化铁胶体中的胶体粒子 | |
| D. | 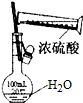 可用来配制一定物质的量浓度的稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4 NA | |
| B. | 标准状况下,2.24L苯中含有的C-H键的数目为0.6NA | |
| C. | 1 L 0.01 mol•L-1 KAl(SO4)2溶液中,含有的阳离子数目为0.02NA | |
| D. | 反应KIO3+6HI=3I2+KI+3H2O,每生成1.5mol I2转移电子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com