
 ;
;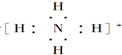 ;
;分析 (1)S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,用小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数;
(2)铵根离子中4个氢原子与氮原子个共用1对电子;
(3)同主族从上到下随着卤原子核电荷数逐渐增大,氢化物的稳定性逐渐减弱,原子半径依次增大,H-X键长增大,键能减小,结构相似的分子晶体,熔沸点与式量成正比,HF分子间含有氢键沸点较高;
(4)锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,铜为正极,正极上氢离子得电子发生还原反应,电子从负极流向正极,阳离子从负极移向正极,以此解答;
(5)漂白粉的主要成分为氯化钙和次氯酸钙,有效成分为次氯酸钙,次氯酸钙易与空气中水、二氧化碳反应生成不稳定的次氯酸,具有强氧化性,可用于杀菌消毒;
(6)根据n=$\frac{m}{M}$计算2mol氢气完全燃烧放出的热量,结合热化学方程式的书写方法写出热化学方程式.
解答 解:(1)S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子结构示意图为 ,
,
故答案为: ;
;
(2)铵根离子中4个氢原子与氮原子个共用1对电子,电子式为: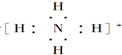 ;
;
故答案为: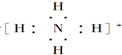 ;
;
(3)非金属性越强,氢化物的稳定性越强,F、Cl、Br、I属于同主族,从上往下,非金属性逐渐减弱,所以其稳定性逐渐减弱,电子层越多,原子半径越大,则原子半径按F、Cl、Br、I的顺序从小到大,H-X键长逐渐增大,键能逐渐减小,不含氢键的氢化物,相对分子质量越大沸点越高,HF分子间含有氢键沸点较高,则卤化氢的沸点由高到低的顺序:HF、HI、HBr、HCl,
故答案为:减弱;增大;减小;HI、HBr、HCl;HF分子间含有氢键;
(4)锌比铜活泼,应为原电池的负极,发生氧化反应,负极的反应式为Zn-2e-═Zn2+,铜为正极,氢离子得电子发生还原反应,2H++2e-=H2↑,电子从负极流向正极,阳离子从负极移向正极,
故答案为:Zn-2e-═Zn2+;还原;负;正极;
(5)漂白粉的主要成分为氯化钙和次氯酸钙,有效成分为次氯酸钙,次氯酸钙和二氧化碳、水反应生成碳酸钙和次氯酸,次氯酸具有漂白性,反应方程式为CO2+H2O+Ca(ClO)2=CaCO3↓+2HClO,反应的离子方程式为:CO2+Ca2++2ClO-+H2O═CaCO3↓+2HClO,
故答案为:CO2+Ca2++2ClO-+H2O═CaCO3↓+2HClO;
(6)4g氢气的物质的量为:n=$\frac{m}{M}$=$\frac{4g}{2g/mol}$=2mol,2molH2在O2中完全燃烧生成2.00mol液态H2O放出571.6kJ的热量,该反应的热化学方程式为:2H2(g)+O2(g)=H2O(l)△H=-571.6KJ/mol;
故答案为:2H2(g)+O2(g)=H2O(l)△H=-571.6KJ/mol.
点评 本题考查较为综合,涉及常见化学用语使用、元素周期律、原电池、热反应方程式的书写等,主要是考查学生对常见化学用语的熟悉掌握程度,题目难度不大.


科目:高中化学 来源: 题型:解答题
 糠醛(
糠醛(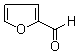 )可与新制含有NaOH的Cu(OH)2悬浊液在加热条件下反应得到砖红色沉淀Cu2O.
)可与新制含有NaOH的Cu(OH)2悬浊液在加热条件下反应得到砖红色沉淀Cu2O. 分子中含有σ键的数目为11mol.
分子中含有σ键的数目为11mol. 分子中碳原子轨道的杂化类型是sp2.
分子中碳原子轨道的杂化类型是sp2. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$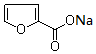 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)→H2O(1)+44.0kJ | B. | 2HI(g)→H2(g)+I2(g)-9.4kJ | ||
| C. | 浓硫酸溶于水 | D. | 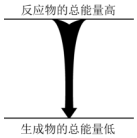 能量变化如图所示的化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量:mol/g | B. | 物质量:mol | ||
| C. | 溶解度:g/100g | D. | 气体摩尔体积:L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LL任何气体都约含NA个气体分子 | |
| B. | 标准状况下,1mol液溴的体积约为22.4L | |
| C. | 1mol铁与足量盐酸反应,转移电子数为3NA | |
| D. | 18gNH4+中含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 方法 | 选用试剂 | 现象 |
| 第一种(萃取) | 氯水、四氯化碳 | 下层溶液显紫色 |
| 第二种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +5、4 | B. | +5、7 | C. | +5、5 | D. | +7、7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com