
����Ŀ��������(C8H10)���������ϵ��屽��ϩ(C8H8)���䷴Ӧԭ���ǣ�C8H10(g)![]() C8H8(g)+H2(g)��H=120kJmol-1ij�¶��£���0.40mol�����飬����2L����ܱ������з�����Ӧ���ⶨ��ͬʱ����������������ʵ������õ��������±���
C8H8(g)+H2(g)��H=120kJmol-1ij�¶��£���0.40mol�����飬����2L����ܱ������з�����Ӧ���ⶨ��ͬʱ����������������ʵ������õ��������±���
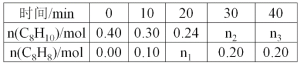
��1������Ӧ���е�20minʱ���ö�ʱ����H2��ƽ����Ӧ������__��
��2�����¶��£���Ӧ��ƽ�ⳣ������ʽ��K=____��K��ֵ��__��
��3�������������������䣬��0.50molH2(g)��0.50molC8H8(g)�ϳ�C8H10(g)������30kJ�����ų�ʱ���÷�Ӧ��H2��ת������__����ʱ���úϳɷ�Ӧ�Ƿ�ﵽ��ƽ��״̬��__����������������������������Ӧ����__�淴Ӧ���ʣ�����ڡ�С�ڻ���ڣ���
���𰸡�0.004mol��L-1��min-1 ![]() 0.1 50% �� ����
0.1 50% �� ����
��������
����ͼ�����ݼ����ʱ���ʽ�����������ʣ����������Ϣ��ƽ��ʱ���ʵ�Ũ�ȼ���ƽ�ⳣ����ת���ʣ�������ƽ�ⳣ���жϷ�Ӧ�Ƿ�ﵽƽ�⼰���淴Ӧ���ʴ�С��
��1����0.40mol�����飬����2L����ܱ������з�����Ӧ��20min��ʣ��0.24mol��������0.16mol����

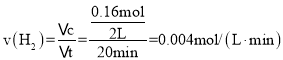 ���ʴ�Ϊ��0.004mol��L-1��min-1��
���ʴ�Ϊ��0.004mol��L-1��min-1��
��2�����������Ϣ֪��ƽ��ʱ������ϩ(C8H8)Ϊ0.2mol����

��ѧƽ�ⳣ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() �� 0.1��
�� 0.1��
��3����C8H10(g) ![]() C8H8(g)+H2(g) ��H=120kJmol-1����֪C8H8(g)+H2(g)
C8H8(g)+H2(g) ��H=120kJmol-1����֪C8H8(g)+H2(g) ![]() C8H10(g) ��H=120kJ��mol1����30kJ�����ų�ʱ�����ĵ�H2��Ϊ0.25mol����������ת����=
C8H10(g) ��H=120kJ��mol1����30kJ�����ų�ʱ�����ĵ�H2��Ϊ0.25mol����������ת����=![]() �����ݣ�2������ƽ�ⳣ��=0.1��֪C8H8(g)+H2(g)
�����ݣ�2������ƽ�ⳣ��=0.1��֪C8H8(g)+H2(g) ![]() C8H10(g)��ƽ�ⳣ��Ϊ
C8H10(g)��ƽ�ⳣ��Ϊ![]() ����
����

![]() ��8<10����Ӧδ��ƽ��״̬�����������ƶ�������Ӧ���ʴ����淴Ӧ���ʣ��ʴ�Ϊ��50%�����ڡ�
��8<10����Ӧδ��ƽ��״̬�����������ƶ�������Ӧ���ʴ����淴Ӧ���ʣ��ʴ�Ϊ��50%�����ڡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A��C��H��O����Ԫ����ɣ���Է�������Ϊ90����9.0gA��ȫȼ�յIJ�������ͨ��������Ũ����ͼ�ʯ�ң��ֱ�����5.4g��13.2g��A����NaHCO3��Һ������Ӧ����2����A֮����ˮ��������Ԫ��������й�A��˵����ȷ���ǣ� ��
A.����ʽ��C3H8O3
B.A�������IJ����ܷ���������Ӧ
C.0.1 molA������Na��Ӧ����2.24LH2����״����
D.A��һ�������·������۷�Ӧ�IJ�����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȳ裬�Ժܶ�����˵��������һ����֣���Ҷ�к��������Ŀ����������������Ѫ�ܡ��̼����Ե����ã���100 ��ʱʧȥ�ᾧˮ����ʼ������120 ��ʱ�����൱������178 ��ʱ�����ܿ졣�ṹ��ʽ���£�

ʵ���ҿ�ͨ�����м����Ӳ�Ҷ����ȡ������

(1)������ķ���ʽΪ_____________��
(2)����1���ݲ�Ҷ���õ��ܼ����Ϊ________��
A��ˮ��B���ƾ���C��ʯ����
(3)����1������4�����еIJ������ֱ���________��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����к�����������![]() ������������
������������![]() �����ӷ�����ȷ����
�����ӷ�����ȷ����
A.�Ҵ�![]() ����
����![]() ������̼������Һ�������ã���Һ
������̼������Һ�������ã���Һ
B.������![]() ����
����![]() ���������NaOH��Һ�У������ã���Һ
���������NaOH��Һ�У������ã���Һ
C.��ȩ![]() ��������
��������![]() ����������������Һ�������ã���Һ
����������������Һ�������ã���Һ
D.������![]() ��
��![]() ���������Ȼ�̼�������ã���Һ
���������Ȼ�̼�������ã���Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��CO(g)��CuO(s)![]() CO2(g)��Cu(s)�ͷ�Ӧ��H2(g)��CuO(s)
CO2(g)��Cu(s)�ͷ�Ӧ��H2(g)��CuO(s)![]() Cu(s)��H2O(g)����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�Ӧ��CO(g)��H2O(g)
Cu(s)��H2O(g)����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�Ӧ��CO(g)��H2O(g)![]() CO2(g)��H2(g)��ƽ�ⳣ��ΪK��������˵����ȷ����(����)
CO2(g)��H2(g)��ƽ�ⳣ��ΪK��������˵����ȷ����(����)
A. ��Ӧ�ٵ�ƽ�ⳣ��K1��c(CO2).c(Cu)/c(CO).c(CuO)
B. ��Ӧ�۵�ƽ�ⳣ��K��K1/K2
C. ���ڷ�Ӧ�ۣ�����ʱ���¶����ߣ�H2Ũ�ȼ�С����÷�Ӧ���ʱ�Ϊ��ֵ
D. ���ڷ�Ӧ�ۣ����º����£�����ѹǿ��H2Ũ��һ����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽�����Ʊ�����ˮ�ɷֵ�ʵ��ʱ����ʵ������ó��Ľ��۴������
A.��ˮ��dz����ɫ��˵����ˮ�к���Cl2
B.����ˮ�еμ������ữ��AgNO3��Һ��������ɫ������˵����ˮ�к�Cl��
C.����ˮ�еμ�NaHCO3�������ݲ�����˵����ˮ�к���HCl��HClO
D.��FeCl2��Һ�еμ���ˮ����Һ����ػ�ɫ��˵����ˮ�к���HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж��ֻ�����ڹ�ҵ����;�㷺����������AlN���л���̼����������Ϊȷ��ij��������Ʒ�Ĵ��ȣ���������ʵ�飺����֪��AlN + H2O + NaOH�� NaAlO2 + NH3����
��1����ȡ5.00g��Ʒ������25mL5mol/L��NaOH��Һ�����ȣ���Ʒ��AlN��Al2O3��ȫ��Ӧ����÷ų�����1.68L����״����������Ʒ�е�A1N����������Ϊ___________��
��2���������������Һ������Һ�еμ�2mol/L�����ᣬ������202mLʱ���ɵİ�ɫ����ǡ����ȫ��ʧ��5.00g��Ʒ��Al2O3�����ʵ����Ƕ���Ħ________����д��������̣�
��ʽ̼����þ[MgxAly��OH��a��CO3��b��nH2O]����Ϊ�������ϡ�Ϊȷ��ij��ʽ̼����þ����ɣ���������ʵ�飺
��3����ȡ3.390g��Ʒ������ϡ�����ַ�Ӧ�����ɶ�����̼0.560L����״������3.390g��Ʒ�к�CO32�D________g��
��4����ȡ100.00g��Ʒ�ڿ����м��ȣ������������¶ȵı仯��ͼ��ʾ����Ʒ��270��ʱ����ȫʧȥ�ᾧˮ��600�����Ϲ���Ϊ����������Ļ�����

��i��100.00g��Ʒ�к��ᾧˮ_______mol��
��ii��100.00g��Ʒ��OH�D�����ʵ����Ƕ���_______����д��������̣�
��iii��ͨ�������Ʋ�ü�ʽ̼����þ�Ļ�ѧʽ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ˮ�г�����һ������Cr2O72-��CrO42-�����ǻ�����༰��̬ϵͳ�����ܴ�Σ����������д��������õĴ����������������֣�
����1����ԭ������
�÷��Ĺ�������Ϊ��
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
���еڢٲ�����ƽ��2CrO42-����ɫ��+2H+![]() Cr2O32-����ɫ��+H2O
Cr2O32-����ɫ��+H2O
(1)��ƽ����ϵ��pH=2������Һ��______ɫ��
(2)��˵���ڢٲ���Ӧ��ƽ��״̬����_____������ţ�
A��Cr2O72-��CrO42-��Ũ����ͬ
B��2v��Cr2O72-��=v��CrO42-��
C����Һ����ɫ����
(3)�ڢڲ��У���ԭ1mol Cr2O72-���ӣ���Ҫ______mol��FeSO4��7H2O��
(4)�ڢ۲����ɵ�Cr(OH)3����Һ�д������³����ܽ�ƽ�⣺Cr(OH)3(s) ![]() Cr3+(aq)+3OH(aq)�������£�Cr(OH)3���ܶȻ�Ksp=c(Cr3+)��c3(OH)=1032��Ҫʹc(Cr3+)����105mol/L����Һ��pHӦ����______��
Cr3+(aq)+3OH(aq)�������£�Cr(OH)3���ܶȻ�Ksp=c(Cr3+)��c3(OH)=1032��Ҫʹc(Cr3+)����105mol/L����Һ��pHӦ����______��
����2����ⷨ
�÷���Fe���缫��⺬Cr2O72-�����Է�ˮ�����ŵ��Ľ��У�������������ҺpH���ߣ�����Cr(OH)3������
(5)��Fe���缫��ԭ��Ϊ______���õ缫��Ӧʽ���ͣ���
(6)������������ҺpH���ߣ���Һ��ͬʱ���ɵij�������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Cl2����ͨ��ˮ�������ͣ�Ȼ���ٵμ�0.1 mol��L��1��NaOH��Һ��������������Һ��pH�仯������ͼ��ʾ������ѡ����ȷ����(����)

A. a����ʾ����Һ��c(H��)��c(Cl��)��c(HClO)��c(OH��)
B. b����ʾ����Һ��c(H��)��c(Cl��)��c(HClO)��c(ClO��)
C. c����ʾ����Һ��c(Na��)��c(HClO)��c(ClO��)
D. d����ʾ����Һ��c(Na��)��c(ClO��)��c(Cl��)��c(HClO)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com