
【题目】双氧水(H2O2)和水都是极弱的电解质,但H2O2 溶液显弱酸性。把H2O2 看成二元弱酸,则下列化学方程式不正确的是
A. H2O2 在水中电离的离子方程式:H2O2![]() H++HO2-
H++HO2-
B. 少量Na2O2与稀盐酸反应的离子方程式:O22-+2H+==H2O2
C. H2O2 稀溶液与Ba(OH)2稀溶被反应生成正盐的化学方程式:H2O2 +Ba(OH)2=BaO2+2H2O
D. H2O2 稀溶液与Ba(OH)2 稀溶液反应生成酸式盐的化学方程:2H2O2 +Ba(OH)2=Ba(HO2)2+2H2O
科目:高中化学 来源: 题型:
【题目】t℃时,将2mol SO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)2SO3(g),2min时反应达到化学平衡,此时测得反应物O2还剩余0.2mol,请填写下列空白:
(1)从反应开始到化学平衡,生成SO3的平均反应速率为;平衡时SO2转化率为 .
(2)下列叙述能证明该反应已达到化学平衡状态的是 .
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n mol SO2的同时消耗n mol O2
E.相同时间内消耗2n mol SO2的同时生成n mol O2
(3)t℃时,该反应的平衡常数为
(4)t1℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了10%.SO2的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。下列说法不正确的是
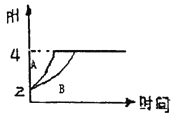
A. 图中表示醋酸溶液中pH变化曲线的是B
B. 设盐酸和醋酸中加入的Zn质量分别为m1、m2,则m1<m2
C. pH=2时盐酸和醋酸的物质的量前者小
D. pH=4时两溶液c(Zn2+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分,请用化学用语回答有关问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ⑨ | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)①和⑧的元素符号是和;
(2)元素⑥形成的氢化物的电子式是;
(3)表中能形成两性氢氧化物的元素是(填写元素符号),请写出该元素的氢氧化物与⑨最高价氧化物对应的水化物发生反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有四种离子,已知其中三种离子 Na+、Ca2+、NO3-的物质的量浓度分别是 2mol/L、1 mol/L、1 mol/L,则溶液中另一离子及其物质的量浓度是
A. CO32- 1.5 mol/L B. K+ 0.5 mol/L
C. OH- 3 mol/L D. Cl 2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每年10月23日上午6:02到晚上6:02被脊为“摩尔日"(Mole Day),这个时间的美式写法为6:0210/23,外观与阿伏加德罗常数6.02×1023相似。NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下22.4 LNO与11.2LO2 充分反应,产物的分子数为NA
B. 0.1mol/L的Na2SO4溶液中,SO42- 数目是0.1NA
C. 标准状况下.22.4L氯气与足量铁粉充分反应,转移的电子数为3NA
D. 0.1molCH4的核外电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式写正确的是
A. 石灰石上滴加稀醋酸: CaCO3+2H+=Ca2++ H2O+CO2↑
B. 向沸水中滴加FeCl3溶液制Fe(OH)3胶体: Fe3++3H2O ![]() Fe(OH)3↓+ 3H+
Fe(OH)3↓+ 3H+
C. 少量SO2通入Ca(ClO)2溶液中: SO2+ H2O + Ca2++ 2ClO-= CaSO3↓+2HClO
D. 澄清石灰水与少量小苏打溶液混合: Ca2++ OH-+ HCO3-=CaCO3↓+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为﹣80℃,沸点137.1℃.在空气中强烈发烟,易与水发生反应.人们使用它作橡胶硫化剂使橡胶硫化,改变生橡胶受热发粘遇冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2 . 下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去). 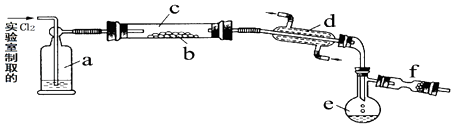
(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式 .
(2)装置a中应放试剂为 , 其作用为 .
(3)该实验的操作顺序应为:②﹣(用序号表示). ①加热装置c ②通入Cl2③通冷凝水 ④停止通Cl2⑤停止加热装置c
(4)f装置中应放置的试剂为 , 其作用为 .
(5)已知S2Cl2与H2O反应时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com