
【题目】合成氨工业上常用下列方法制备H2:
方法I:C(s)+2H2O(g) ![]() CO2(g)+2H2(g)
CO2(g)+2H2(g)
方法Ⅱ:CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知
①C(s,石墨)+O2(g)=CO2(g) △H1=一394 kJ·mol一1
②2C(s,石墨)+O2(g)=2CO(g) △H2=一222 kJ·mol-1
③2H2(g)+O2(g)= 2H2O(g) △H3=一484 kJ·mol-1
试计算25℃时由方法Ⅱ制备1 000 g H2所放出的能量为______________。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应C(s)+2H2O(g) ![]() CO2(g)+2H2(g)。其相关数据如下表所示:
CO2(g)+2H2(g)。其相关数据如下表所示:

①T1____T2(填“>”“=”或“<”);T1℃时,该反应的平衡常数K=______________。
②乙容器中,当反应进行到1.5 min时,H2O(g)的物质的量浓度范围是__________。
③在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是____________(填序号)。
A.V逆(CO2)=2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均摩尔质量保持不变
(3) 现有0.175 mol/L 醋酸钠溶液500 mL(已知醋酸的电离平衡常数K=1.75×10-5)。
①下列图像能说明醋酸钠的水解反应在t1时刻达到平衡的是________(填序号,下同)。
A.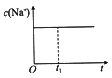 溶液中c(Na+)与反应 时间t的关系
溶液中c(Na+)与反应 时间t的关系
B. CH3COO一的水解速率与反应时间t的关系
CH3COO一的水解速率与反应时间t的关系
C . 溶液的pH与反应时间t的关系
溶液的pH与反应时间t的关系
D. K与反应时间t的关系
K与反应时间t的关系
②在醋酸钠溶液中加入下列少量物质,水解平衡向正反应方向移动的有_____________ 。
A.冰醋酸B.纯碱固体c.醋酸钙固体D.氯化铵固体
(4)在醋酸钠溶液中加入少量冰醋酸后,溶液中微粒浓度的关系式能成立的有________。
A.c(CH3COO一)+c(CH3COOH)>c(Na+)
B.c(Na+)> c(CH3COO一)>c(H+)>c(OH一)
C.c(CH3COO一)> c(Na+)> c(H+)>c(OH一)
D.c(CH3COO一)>c c(H+)>c(OH一)> c(Na+)
(5)欲配制0.175 mol/L醋酸钠溶液500 mL,可采用以下两种方案:
方案一:用托盘天平称取_________g无水醋酸钠,溶于适量水中,配成500 mL溶液。
方案二:用体积均为250 mL且浓度均为_____________的醋酸与氢氧化钠溶液混合而成(设混合后的体积等于混合前两者体积之和)。在室温下,0.175 mol/L醋酸钠溶液的pH约为_______________。
【答案】 20500 KJ > 12.8 大于 0.8mol/L 小于1.4 mol/L BD BC CD AC 7.2 0.35mol/L 9
【解析】(1)CO(g)+H2O(g)CO2(g)+H2(g)的,△H=△H1-△H2-△H3=-394kJmol-1-(-111kJmol-1)-(-242kJmol-1)=-41kJmol-1,所以制备1000g H2所放出的能量为20500kJ,故答案为:20500 kJ;
(2)①如果两者温度相等,甲相对乙,甲平衡时H2(g)平衡量为2.4mol,而是3.2,说明温度改变平衡正向移动,而正反应为吸热反应,所以T1>T2;
由表中数据可知,平衡时氢气的物质的量为3.2mol,则:
C(s)+2H2O(g) ![]() CO2(g)+2H2(g)
CO2(g)+2H2(g)
开始(mol):2400
转化(mol):1.63.21.63.2
平衡(mol):0.40.81.63.2
平衡常数K= =
=![]() =12.8,故答案为:>;12.8;
=12.8,故答案为:>;12.8;
②3min内水蒸气的浓度变化量=氢气的浓度变化量的=![]() =1.2mol/L,随反应进行,物质的浓度降低,反应速率变小,故前1.5min水的浓度变化量大于后1.5min水的浓度变化量,故反应进行到1.5min时,H2O(g)的物质的量浓度小于2mol/L-1.2mol/L×
=1.2mol/L,随反应进行,物质的浓度降低,反应速率变小,故前1.5min水的浓度变化量大于后1.5min水的浓度变化量,故反应进行到1.5min时,H2O(g)的物质的量浓度小于2mol/L-1.2mol/L×![]() =1.4mol/L,但需要大于平衡时的0.8mol/L,故答案为:0.8mol/L <c(H2O)<1.4mol/L;
=1.4mol/L,但需要大于平衡时的0.8mol/L,故答案为:0.8mol/L <c(H2O)<1.4mol/L;
③A.V逆(CO2)= ![]() V逆(H2)=2V正(H2),正逆速度不等,故不选;B混合气体的密度保持不变,说明气体质量不变,正逆速度相等,故选;C.c(H2O):c(CO2):c(H2)=2:1:2,而不是不变,故不选;D.混合气体的平均相对分子质量未平衡时在变,现在保持不变,说明已达平衡状态,故选;故选BD;
V逆(H2)=2V正(H2),正逆速度不等,故不选;B混合气体的密度保持不变,说明气体质量不变,正逆速度相等,故选;C.c(H2O):c(CO2):c(H2)=2:1:2,而不是不变,故不选;D.混合气体的平均相对分子质量未平衡时在变,现在保持不变,说明已达平衡状态,故选;故选BD;
(3)①A.钠离子不水解,所以浓度始终不变,故A错误;B.醋酸根离子开始时水解速率最大,后逐渐减小,平衡时不再变化,故B正确;C.随着水解的逐渐进行,pH逐渐增大,平衡时不再变化,故C正确;D.KW是一温度常数,温度不变,KW不变,故D错误;故选BC;
②A.加入冰醋酸溶液中醋酸浓度增大,平衡左移,故A错误;B.加入纯碱固体,对平衡体系的离子浓度无影响,平衡不移动,故B错误;C.加入醋酸钙固体,溶液在醋酸根离子浓度增大,平衡右移,故C正确;D.加入氯化铵固体,铵根离子与水解生成的氢氧根离子结合成一水合氨,使溶液中氢氧根离子浓度减小,平衡右移,故D正确;故选CD;
(4)A.加入冰醋酸,使醋酸根离子浓度增大,但钠离子浓度不变,所以存在c(CH3COO-)+c(CH3COOH)>c(Na+),故A正确;B.加入少量冰醋酸,平衡左移,醋酸根离子浓度增大,大于钠离子浓度,故B错误;C.加入冰醋酸,当溶液中醋酸浓度较大时,醋酸的电离大于醋酸根离子的水解程度,醋酸根离子浓度增大,溶液呈酸性,故C正确;D.无论是否电离程度大于水解程度,都不会存在c(OH-)>c(Na+),故D错误;故选AC;
(5)有m=nM=cVM=0.175mol/L×0.5L×82g/mol=7.175g,所以托盘天平称量的质量为7.2g,醋酸与氢氧化钠等浓度等体积混合,混合后的溶液浓度减半为0.175mol/L,所以原来的浓度为0.35mol/L,故答案为:7.2;0.35mol/L。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为__________________:
(2)A与溴的四氯化碳溶液反应的化学方程式为____________________________,反应类型是________;
(3)已知: 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式______________________________;
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式______________________________;
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式____________________________;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
环己烯是一种重要的有机合成原料。下图是以环己烯为原料进行多种有机物合成的路线:
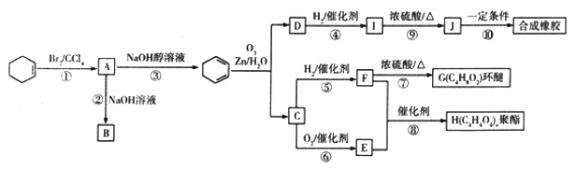
已知以下信息:
(ⅰ)其中F可以作内燃机的抗冻剂;
(ⅱ)J分子中无饱和碳原子;
(ⅲ) Rl—CH=CH—R2 ![]() R1—CHO+R2—CHO
R1—CHO+R2—CHO
回答下列问题:
(l)与① 反应类型相同的是________(填序号)。
(2)I生成J的化学方程式为______,反应⑩的生成物“合成橡胶”的结构简式为______。
(3)E的化学名称是___________。
(4)F的结构简式为___________,含有的官能团名称是___________。
(5)能与NaHCO3溶液反应放出CO2的B的同分异构体共有_______种,其中核磁共振氢谱有4 组峰,且峰面积比为1:1:4:6 的是___________(填结构简式)。
(6)参照上述合成路线,以2—戊烯(CH3CH=CHCH2CH3)为原料(其他无机试剂任选),设计制备乙二酸二乙酯的合成路线:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是
A. KI(淀粉溶液) B. FeCl2溶液(KSCN)
C. Na2SO3溶液(BaCl2) D. HCHO溶液(石蕊试液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是 ( )

A. 元素X 与元素Z 的最高化合价之和的数值等于8
B. 原子半径的大小顺序为r(X)>r(Y)>r(Z)>r(W)>r(Q)
C. 可以通过电解Z元素的氯化物得到Z单质
D. 元素W的最高价氧化物对应水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学使用化学肥料是保障农作物增产的重要措施。下列化肥中具有复合肥效的是( )
A. (NH4)2SO4 B. KNO3
C. CO(NH2)2 D. NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、N、O、Na、S、Cl都是中学化学中的常见元素,根据题意回答与这些元素有关的问题:
(1)画出Na原子结构示意图_______,Na2O2可用作供氧剂,其电子式为_______。
(2)Cl2是一种大气污染物,装有液氯的钢瓶上应贴的标签是_______(填编号)。

氯气泄漏可用NaHSO3溶液来处理,写出相关的离子反应方程式_____________。
(3)25C时,利用pH试纸测得0.1mol/L氨水的pH约为11,则可以估算出氨水的电离常数约为_____;向10mL此溶液中通入少量氨气,忽略溶解过程中溶液温度和体积的微小变化,溶液中![]() 将_______(填“增大” “减小”或“无法确定”)。
将_______(填“增大” “减小”或“无法确定”)。
(4)有两种化合物同时含有上述六元素中的四种元素。将这两种化合物的溶液混合后,恰好完全反应,生成物之一M仍含有这四种元素,该反应的离子方程式为______________。若M溶液的pH =5,则由水电离出的c(H+)=_______mol/L,该溶液离子浓度由大到小的顺序为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com