
| KOH |
| 室温 |

| 12n |
| 12n+2n+2+16 |
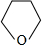
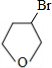 ,D和E为
,D和E为 、
、 .
.| 12n |
| 12n+2n+2+16 |
 ,D和E为
,D和E为 、
、 ,
, ,故答案为:加成反应;取代反应;
,故答案为:加成反应;取代反应; ,D和E为
,D和E为 、
、 ,故答案为:
,故答案为: ;
; ;
; ;
; 与NaOH水溶液反应的化学方程式:
与NaOH水溶液反应的化学方程式: +NaOH
+NaOH| 水 |
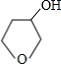 +NaBr,故答案为:
+NaBr,故答案为: +NaOH
+NaOH| 水 |
 +NaBr;
+NaBr;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
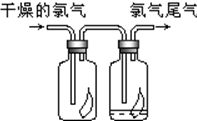 (1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气.写出该反应的离子方程式查看答案和解析>>
科目:高中化学 来源: 题型:
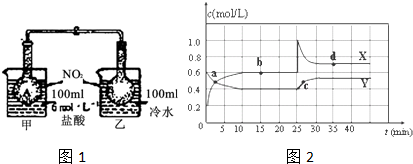
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸干AlCl3溶液可得纯净的无水氯化铝 |
| B、用碱式滴定管量取20.00mL酸性高锰酸钾溶液 |
| C、用pH试纸测定溶液的pH时预先要用蒸馏水湿润 |
| D、实验室配制SnCl2 溶液时,需要加入少量的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 熔点 | 沸点 | 密度 | 溶解性 |
| 9.79℃ | 131.4℃ | 2.18g?cm-3 | 难溶于水,易溶于醇、醚等 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | H2O2溶液浓度/% | H2O2溶液体积/mL | 温度/℃ | MnO2用量/g |
| A | 5 | 10 | 20 | 0.1 |
| B | 15 | 10 | 20 | 0.1 |
| C | 20 | 10 | 30 | 0 |
| D | 20 | 10 | 30 | 0.1 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com