
| A. | F-的结构示意图: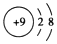 | |
| B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| C. | S2-的结构示意图: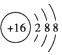 | |
| D. | 原子核内有18个中子的氯原子:${\;}_{17}^{35}$Cl |
分析 A、氟元素原子核内有9个质子,氟离子质子数也是9,核外电子数是10;
B、元素符合左上角是质量数,等于质子数加上中子数;
C、硫离子质子数为16,核外电子数为18;
D、原子核内有18个中子的氯原子,则质量数为17+18=35;
解答 解:A、氟元素原子核内有9个质子,氟离子质子数也是9,核外电子数是10,所以F-的结构示意图: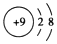 ,故A正确;
,故A正确;
B、元素符合左上角是质量数,等于质子数加上中子数,所以中子数为20的氯原子:${\;}_{17}^{37}$Cl,故B错误;
C、硫离子质子数为16,核外电子数为18,所以S2-的结构示意图: ,故C正确;
,故C正确;
D、原子核内有18个中子的氯原子,则质量数为17+18=35,所以氯原子为${\;}_{17}^{35}$Cl,故D正确;
故选B.
点评 本题考查常用化学用语的书写,难度不大,注意结构简式的书写,原子结构示意图与离子结构示意图的区别.


科目:高中化学 来源: 题型:实验题

| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码)过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+﹑Ca2+﹑Cl-﹑CO32- | B. | Na+、Ca2+、HCO3-、NO3- | ||
| C. | Cu2+﹑Cl-﹑Ca2+﹑NO3- | D. | NO3-﹑Na+﹑Ca2+﹑Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 | |
| B. | 除去苯中少量的苯酚:加溴水,振荡,过滤除去沉淀 | |
| C. | 只用溴水就可以将苯、四氯化碳、酒精、已烯、苯酚这五种物质区别开来 | |
| D. | 溴乙烷水解后的溶液中直接加入AgNO3溶液用来检验溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}、点燃}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | H2SO4$\stackrel{Cu}{→}$SO2$\stackrel{BaCl_{2}溶液}{→}$BaSO3 | |
| C. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | SiO2$\stackrel{NaOH}{→}$Na2SiO3$\stackrel{HCl}{→}$H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=[Al(OH)4]-+4 NH4+ | |
| B. | 澄清石灰水与小苏打溶液混合:Ca2++CO32-=CaCO3↓ | |
| C. | Na[Al(OH)4]溶液中加入过量盐酸:AlO2-+H++H2O=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象或事实 | 解释 |
| A | 检验待测溶液中SO42-,先滴入稀盐酸,再滴入BaCl2溶液 | 先滴入盐酸可排除Ag+、CO3-、SO32-等离子干扰 |
| B | 铝箔插入稀硝酸中 | 铝箔表面被HNO3氧化形成致密的氧化膜 |
| C | 向Fe(NO3)2溶液中加入稀硫酸,试管口有红棕色气体产生 | 溶液中NO3-被Fe2+还原为NO2 |
| D | 含Mg(HCO3)2的硬水长时间充分加热,最终得到的沉淀物的主要成分为Mg(OH)2而不是MgCO3 | Kap(MgCO3)<Kap[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com