

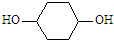
 ,写出正确的合成路线:
,写出正确的合成路线: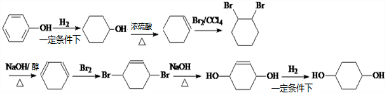 .
. 分析 以苯酚为原料,其他无机试剂任选,合成 ,先用苯酚和氢气发生加成反应生成环己醇,环己醇再和浓硫酸混合加热发生消去反应生成环己烯,环己烯和溴发生加成反应生成1,2-二溴环己烷,1,2-二溴环己烷和NaOH的醇溶液加热发生消去反应生成1,3-环己二烯,1,3-环己二烯和溴在较低温度下发生1,4加成生成1,4-二溴-2-环己烯,1,4-二溴-2-环己烯和NaOH的水溶液发生取代反应生成
,先用苯酚和氢气发生加成反应生成环己醇,环己醇再和浓硫酸混合加热发生消去反应生成环己烯,环己烯和溴发生加成反应生成1,2-二溴环己烷,1,2-二溴环己烷和NaOH的醇溶液加热发生消去反应生成1,3-环己二烯,1,3-环己二烯和溴在较低温度下发生1,4加成生成1,4-二溴-2-环己烯,1,4-二溴-2-环己烯和NaOH的水溶液发生取代反应生成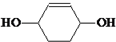 ,
, 和氢气发生加成反应生成
和氢气发生加成反应生成 ,据此分析解答.
,据此分析解答.
解答 解:以苯酚为原料,其他无机试剂任选,合成 ,先用苯酚和氢气发生加成反应生成环己醇,环己醇再和浓硫酸混合加热发生消去反应生成环己烯,环己烯和溴发生加成反应生成1,2-二溴环己烷,1,2-二溴环己烷和NaOH的醇溶液加热发生消去反应生成1,3-环己二烯,1,3-环己二烯和溴在较低温度下发生1,4加成生成1,4-二溴-2-环己烯,1,4-二溴-2-环己烯和NaOH的水溶液发生取代反应生成
,先用苯酚和氢气发生加成反应生成环己醇,环己醇再和浓硫酸混合加热发生消去反应生成环己烯,环己烯和溴发生加成反应生成1,2-二溴环己烷,1,2-二溴环己烷和NaOH的醇溶液加热发生消去反应生成1,3-环己二烯,1,3-环己二烯和溴在较低温度下发生1,4加成生成1,4-二溴-2-环己烯,1,4-二溴-2-环己烯和NaOH的水溶液发生取代反应生成 ,
, 和氢气发生加成反应生成
和氢气发生加成反应生成 ,其流程图为
,其流程图为 ,
,
故答案为: .
.
点评 本题考查有机物合成,为高考高频点,侧重考查学生知识运用能力,明确常见有机物官能团及其性质、常见反应类型、反应条件即可解答,可以根据目标采用采用逆向思维方法进行判断,题目难度中等.


 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:填空题
 ,取代反应;
,取代反应; ,加聚反应.
,加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .C、D还可形成化合物D2C2,D2C2含有的化学键是离子键、非极性共价键(或离子键、共价键).
.C、D还可形成化合物D2C2,D2C2含有的化学键是离子键、非极性共价键(或离子键、共价键).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答: CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 甲 | 乙 | |
| 丙 | 丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
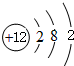 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4无论在水溶液或熔融状态下都可以电离出Na+、H+和SO42- | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | H2SO4在电流作用下在水中电离出H+和SO42- | |
| D. | 液态HCl,固态NaCl均不导电,所以HCl、NaCl都不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 溴苯(液溴) | NaOH溶液 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com