NA为阿伏加德罗常数,下列叙述错误的是( )
A.18gH2O中含有的质子数为10NA
B.12g金刚石中含有的共价键数为4NA
C.常温常压下,46gNO2和N2O4混合气体中含有原子总数为3NA
D.1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
【答案】
分析:运用物质的量与微粒数目、质量、气体体积、物质的量浓度之间的关系分析解答,n=

=
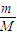
=
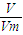
=CV.
解答:解;A.18g水物质的量为1molH
2O,水分子中2个氢原子2个质子,1个氧8个质子,水分子中共10个质子,则1molH
2O中含有10mol质子,数目为10N
A,故A正确;
B.12g金刚石是1mol碳.金刚石的结构是按四面体成键的,一个碳上连着四个共价键,但是一个共价键是两个碳共用的,所以说共价键数应该小于4N
A,故B错误;
C.把四氧化二氮全部转换成二氧化氮,这样46g二氧化氮是1mol,原子总数为3N
A,故C正确;
D.氧化钠和过氧化钠中的钠都是+1价的,不一样的是氧的价态,因此1molNa失去N
A个电子,故D正确;
故选B.
点评:本题考查阿伏伽德罗常数的计算,要求微粒数目N,必须要先求得物质的量n,所以解题关键是要通过质量m、气体体积V、溶液物质的量浓度C求出物质的量,最后求微粒数目.

 =
=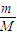 =
=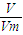 =CV.
=CV.

 金钥匙试卷系列答案
金钥匙试卷系列答案